原标题:JAMA展望:癌症免疫疗法迈入2.0时代,哪些突破值得期待?
2013年,癌症免疫疗法被《科学》杂志评为年度突破。2018年,诺贝尔生理学或医学奖授予两名免疫疗法先驱James Allison教授与本庶佑教授,他们和其他科研人员的开拓性贡献,改变了人类对抗癌症的格局。
在20世纪90年代中期,James Allison教授与本庶佑教授先后发现了免疫系统两个不同的“刹车”,也称为免疫检查点——CTLA-4和PD-1。免疫检查点抑制剂药物够松开这些“刹车”,让免疫系统攻击癌细胞。多款抑制剂已经获得美国FDA批准上市,PD-1抗体pembrolizumab(keytruda,K药)和nivolumab(Opdivo,O药)也在今年来到中国患者身边。
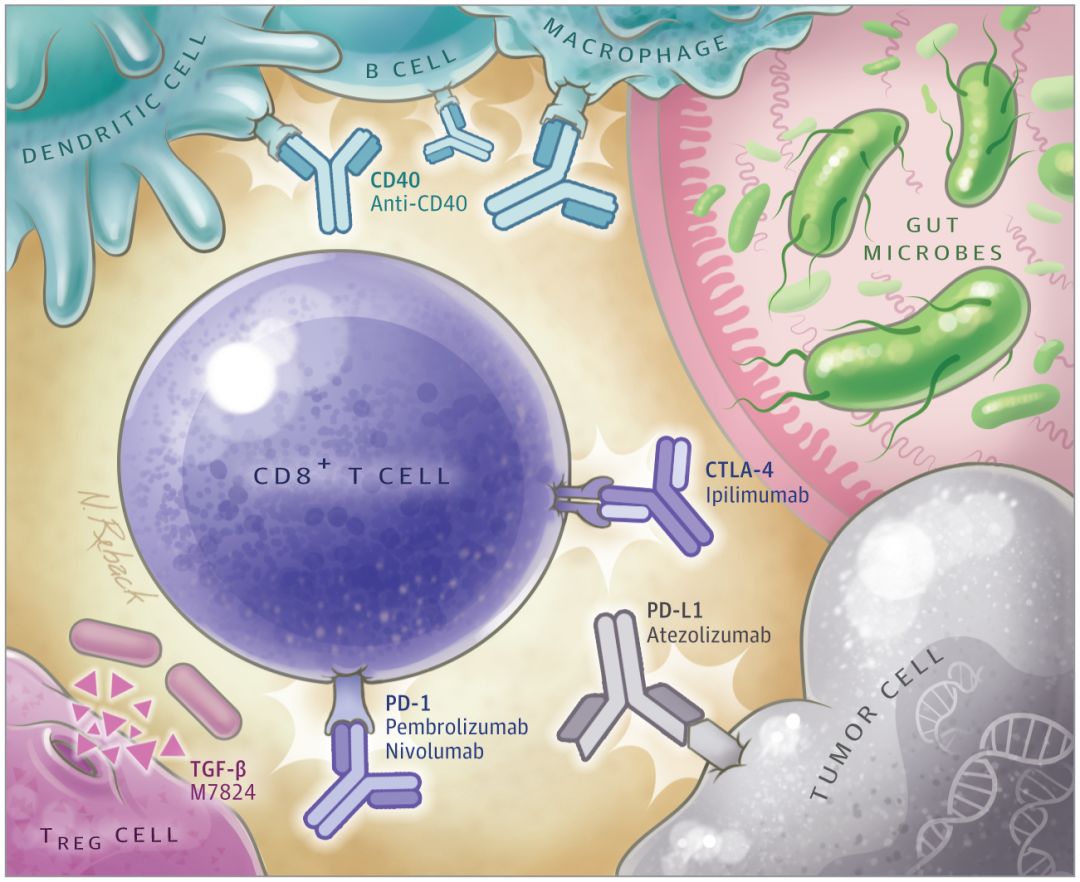
▲免疫系统中,CTLA-4和PD-1是作用于CD8+ T细胞的两个“刹车”(图片来源:JAMA)
这些抗癌药物具有巨大的潜力。然而,目前的检查点抑制剂还只能帮助部分患有某些类型癌症的患者,包括黑色素瘤、肺癌、肾细胞癌、膀胱癌以及具有高突变负荷的微卫星不稳定性癌症。甚至在这些肿瘤类型中,也并非所有患者都对检测点抑制剂有反应。
如何让这些药物治疗效果最大化,毒副作用最小化,并在更多癌症类型中得到应用?不少研究正在试图克服这些问题。近日,全球顶尖医学期刊《美国医学会杂志(JAMA)》对相关进展做了分析盘点。
通过生物标记物预测疗效
目前有近2000项关于检查点抑制剂单药或组合治疗的临床试验正在进行。为了增强疗效,很多试验药物组合都包含了CTLA-4抗体和PD-1/PD-L1抗体,但联合用药也意味着更多的不良事件风险。因此,我们需要可靠的生物标记物来预测疗效,筛选出那些适合用药的患者。
全世界最顶级的癌症中心之一,德克萨斯大学MD安德森癌症中心的免疫治疗平台科学主任Padmanee Sharma博士正在评估肿瘤中CD8+ T细胞浸润是否可以预测患者疗效。
这项研究的前提假设是,高CD8+ 浸润的“热”肿瘤将对像Opdivo这样的PD-1抑制剂起反应,而CD8+ T细胞水平较低的“冷”肿瘤,可能需要CTLA-4抗体的助力,才能驱动T细胞对肿瘤发挥作用。试验将在所有晚期转移癌症患者中开展,根据患者的CD8+ T细胞水平,他们将接受Opdivo单药治疗,或Opdivo和ipilimumab(商品名Yervoy)联合疗法。
另一个正在由FDA评估的生物标记物是肿瘤突变负荷(TMB)。纽约Memorial Sloan Kettering癌症中心Matthew Hellmann博士及其同事在几年前的研究表明,在TMB较高的非小细胞肺癌患者中,keytruda治疗效果较好。自那以后,不少癌症研究都发现了高TMB和检查点抑制剂疗效的正相关性。
这种情况的一个绝佳例子是,在错配修复基因缺陷引起的遗传病患者中,也容易发生高度微卫星不稳定(MSI-H)癌症。2017年,keytruda获得FDA批准用于MSI-H癌症,无论癌症的起源位置如何,这是FDA首次基于生物标志物而非单一肿瘤适应症来批准一款药物。
不过,没有生物标志物是完美的。用于检测PD-L1高表达的4种免疫组化测试已经获得FDA批准用于NSCLC等癌症适应症,但PD-L1表达并不能在所有情况下都准确预测患者对药物的反应。我们需要更多的生物标记物,从不同的角度来预测疗效。
图片来源:123RF
肠道微生物检查
最近的一些研究表明,肠道微生物的多样性和组成是影响检查点抑制剂反应的另一个因素。
MD安德森癌症中心与其合作伙伴将进行1期临床试验来探索这两个因素。参与研究的转移性黑色素瘤患者将随机接受三种治疗之一:含有来自PD-1抗体应答者的粪便微生物群的口服药片;含有模仿这些成分的微生物混合物的口服药片;或安慰剂。
在另一项2期试验中,匹兹堡大学的研究人员正在研究,长期对PD-1抗体有应答的患者的粪便微生物群移植,能否改善PD-1抗体在对其耐药的黑色素瘤患者中的疗效。该研究的目的也是为了确定,哪种特定的微生物群可以调节患者对免疫检查点抑制剂药物的反应。
打破限制疗效的天花板
想要患者对检查点抑制剂有反应,就需要患者的T细胞处于肿瘤微环境中。而许多肿瘤能够逃避T细胞浸润。这是限制了检查点抑制剂疗效的一个天花板。
阻止T细胞进入肿瘤微环境的一个“障碍物”是转化生长因子β(TGF-β)。美国国家癌症研究所的科学家们正在测试一种名为M7824的双功能融合蛋白,它能够将PD-L1抗体与吸收TGF-β的“陷阱”结合起来。M7824已经开始在转移性去势抵抗性前列腺癌中进行1期和2期试验,这种T细胞水平较低的“冷”肿瘤通常免疫反应不强。这项新型试验加速评价了4种实验药物在5个免疫靶点中的作用,研究人员试图一次击中多个免疫目标,打破肿瘤对免疫系统的抵抗力。
▲T细胞进入肿瘤微环境是免疫疗法起效的重要条件(图片来源:By NIAID/NIH (NIAID Flickr's photostream) [Public domain], via Wikimedia Commons)
另一种创新方法是利用CD40抗体疗法来激活免疫系统,并使肿瘤对检查点抑制剂敏感。宾夕法尼亚大学的研究表明,CD40就像一个开关,可以把“冷”肿瘤转化为“热”肿瘤,从而使它们对药物产生足够的免疫反应。
宾夕法尼亚大学团队和帕克研究所合作,正在1b期和2期临床试验中探索CD40抗体可否改善检查点抑制剂(Opdivo)在胰腺癌中的疗效,胰腺癌患者通常对免疫治疗没有反应。另一项试验中,CD40抗体与Opdivo的组合疗法也正在转移性黑素瘤和肺癌患者中进行检验。研究人员希望,在这些最难治的癌症中,加入CD40抗体能够让免疫疗法起效。
更早期,更安全地治疗
在癌症早期就使用免疫疗法也是人们正在探索的目标之一。在疾病早期,肿瘤对免疫系统的防御能力可能还不成熟,对药物的反应就可能更好。去年,Opdivo已被FDA批准用于完全手术切除后具有复发高风险的黑色素瘤患者的辅助治疗。
翰霍普金斯大学医学院Bloomberg-Kimmel癌症免疫疗法研究所的团队正在探索检查点抑制剂在各种癌症的新辅助(手术前)治疗中的应用。今年5月,他们在《New England Journal of Medicine》发表了一项试验性研究结果,首次报道了手术前将Opdivo用于未经治疗的早期非小细胞肺癌患者,45%的患者对药物有反应,安全性良好。
免疫疗法的炎症不良反应也受到了广泛的关注。这些不良事件可能影响任何器官,最常见于皮肤、胃肠道、内分泌腺和肝脏。通过药物剂量调整、停药或类固醇治疗,大多数不良反应可以被缓解,但也可能发生罕见反应或1型糖尿病等不可逆病症。
加州大学旧金山分校教授,帕克研究所(The Parker Institute)总裁兼CEO,Jeffrey Bluestone博士介绍,他们正在制定一项解决免疫疗法不良反应的战略计划,试图了解这些不良反应的生物学,生物化学和遗传基础,以确定最危险的因素并设法避免。
图片来源:pixabay
虽然关于检查点抑制剂还有诸多未知,但这些药物已经彻底改变了癌症治疗,更多科学研究正在更深入地探索、优化免疫疗法的治疗应用。正如Bluestone教授所说,“最重要的是,我们正处于免疫疗法开篇的最后几页,即将进入崭新的下一篇章。”
参考资料
M.J. Friedrich. (2018). Immunotherapy 2.0: Improving the Response to Checkpoint Inhibitors. JAMA, 10.1001/jama.2018.18306




