反义寡核苷酸药动学研究进展
Advance in pharmacokinetic studies of antisense oligonucleotides

来源
中国新药杂志 2018 年第27卷第21 期
作者
付洁,王海学,宋海峰
中国人民解放军军事科学院军事医学研究院生命组学研究所
军科正源( 北京) 药物研究有限责任公司
国家药品监督管理局药品审评中心药理毒理学部
摘要
世纪之交的十余年,反义寡核苷酸( antisense oligonucleotides,AS-ONs) 作为治疗性药物,因受限于稳定性、药物递送、作用机制等核心技术问题,经历了发展低谷期。2016 年一年间,先后有2 个AS-ONs药物获批上市,标志着此类药物在关键技术上取得了突破性进展,重新回到生物技术药物研发的主舞台。
大批新一代针对感染、恶性肿瘤、杜氏肌营养不良等适应证的AS-ONs 进入临床试验,再次显示了其在基因治疗领域令人期待的广阔前景。
本文就AS-ONs 药物的发展代次更迭进行了扼要梳理,并对新代次AS-ONs 药物的定量分析与药动学研究进展予以综述。
正 文
理论上,反义寡核苷酸( antisense oligonucleoti-des,AS-ONs) 通过系统给药,能有效地靶向特定组织,跨越生物膜并在细胞内选择性地发挥治疗作用。
但如何确保其在体内具有良好的药动学( pharmacokinetics,PK) 特性以达成上述使命,却是困扰该类药物进入临床应用的关键壁垒之一。经过了近10 余年蛰伏式的发展平台期,AS-ONs 在核酸修饰、生物共轭、系统递送等关键技术方面都取得了突破,该类药物得以再次迅猛发展。
本文扼要梳理AS-ONs 药物的发展阶段及典型代表,并针对新一代AS-ONs药物的定量分析策略及其药动学特征进行综述。
1
AS-ONs 药物主要发展阶段
AS-ONs 发展阶段主要因分子结构和修饰特点不同而更迭[1]。对AS-ONs 化学修饰的方法主要针对3 个方面,即碱基修饰、核糖修饰和磷酸二酯键修饰。
碱基修饰主要为杂环修饰、5-甲基胞嘧啶和二氨基嘌呤; 核糖修饰主要为己糖。
2'-O-甲基取代核糖、环戊烷、α 构象核糖; 磷酸二酯键修饰主要为硫代和甲基代修饰等。
目前主要有以下代次( 二代以后的代次划分无统一标准) 。
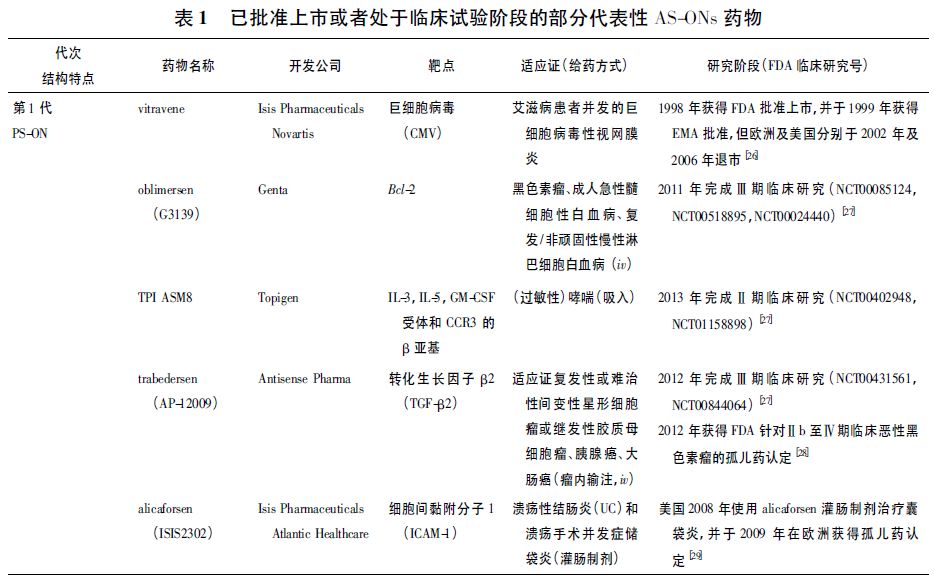
第1 代AS-ONs 主要对寡聚脱氧核苷酸( oligodeoxynucleotides,ODN) 分子骨架进行修饰,以硫代磷酸酯脱氧寡核苷酸( phosphorathioate oligodeoxynucleotides,PS-ODNs) 为主要代表。
与未修饰核苷酸相比,PS-ODNs 很大程度增加其核酸酶抗性,增强组织分布[2 -3]。一般临床给药剂量和方案为每周2 ~3 次,每周给药总量约为每人1.2 ~3. 5 kg。
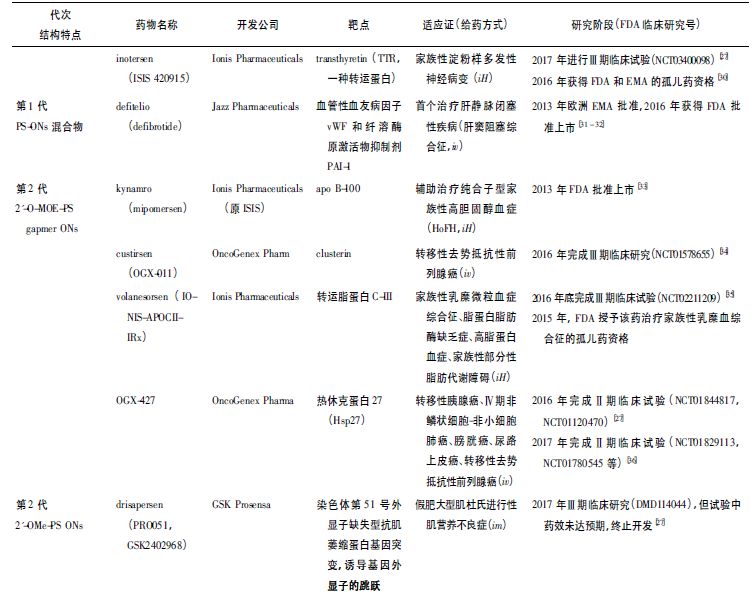
第2 代AS-ONs 结构修饰不限于骨架连接,还包括核糖2' 位置的修饰。如2'-氟( 2'-F) ,2'-甲氧基( 2'-O-methyluridine,2'-OMe ) 和2'-O-甲氧乙基( 2'-O-methoxyethyl,2'-MOE) 修饰等目的主要是增强核酸酶抗性,提高疗效,增加结合亲和力并调节寡核苷酸的蛋白结合,减少非特异毒性[4 -5]。
第1 代PSONs的不良反应主要来自其携带的负电荷和免疫原性[6]: 由于携带负电荷,PS-ONs 及其核酸降解物能与血清蛋白、细胞表面受体结合,或者进入胞内与某些碱性蛋白质或酶结合,产生非特异效应。
此外,PS-ONs 及其核酸降解物中含有多个连续的胞苷磷酸鸟苷序列,也会产生非序列特异性的抑制作用。从二代AS-ONs 药物开始,以混合骨架寡核苷酸( mixed backbone oligonucleic acid,MBO) 为代表,MBO 是根据不同修饰的ONs 特性而加以各种组合。
MBO 通过不同化学修饰的组合降低了硫代磷酸二酯键的数量,减少了自身携带的负电荷,降低了体内降解速度并改变了核酸降解物的种类,从而减少了由硫代导致的不良反应; 提高了与靶mRNA 的结合能力并提高诱导核糖核酸酶H ( ribonuclease H,RNaseH) 降解mRNA 的能力。
其中,gapmer 形式是常用连接形式。gapmer 中央区是一段DNA 单体聚合( gap) ,为14 ~ 16 核苷酸长度的硫代磷酸化。两侧经MOE、锁核酸( locked nucleic acid,LNA) 或者桥基核酸( 2-O-Et-2'4'-briged nucleic acid,cEt) 修饰。
此种药物形式不仅提高靶向亲和性及核酸酶的抗性,其中gapmer 能激活细胞内RNAse H1,完成对所结合的靶mRNA 的裂解。
目前2'-O-MOE-PS gapmerODN,2'-OMe-PS gapmer ODN 是二代AS-ONs 药物常用形式[7]。
在第2 代的基础上,衍生出所谓2.5代AS-ON-cEt。短S-cEt ( S-2α-O-Et-2α,4'-桥基核酸) gapmer AS-ON 相对于亲本MOE 的效力提高约60 倍[8]。
第2 代AS-ONs 药物临床给药剂量和方案一般为每周1 ~ 2 次,每周给药总量约在每人0.1 ~0. 4 kg。
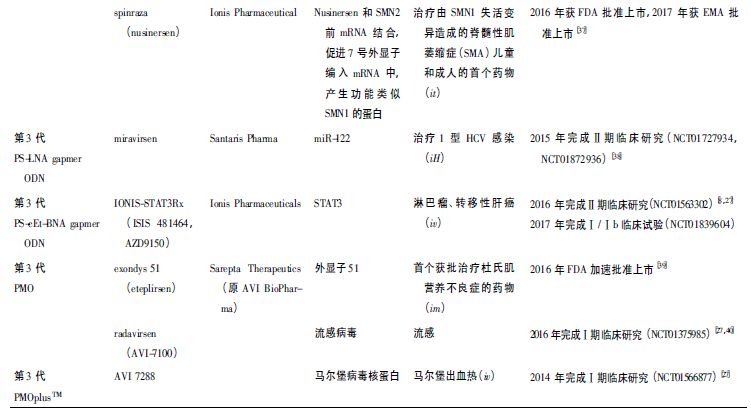
第3 代AS-ONs 主要在结构中进行大幅变化,并包括核糖环和/或磷酸酯骨架内的各种修饰。
这些修饰大幅度改善生物稳定性和细胞摄取,并优化特定分子靶标的组织和细胞分布[9]。主要包括桥连核酸( bridged nucleic acid,BNA) 、肽核酸( peptidenucleic acid,PNA) 和磷酰二胺吗啉代低聚物( phosphorodiamidate morpholino oligomers,PMO) 3 种。
BNA包括第1 代LNA 类似物( 2'-O,4'-亚甲基-β-D-呋喃核糖核苷酸) 和第2 代BNA 化合物2'-O,4 '-C-亚甲基亚甲基桥连核酸( BNANC ) 。
该类结构修饰是少数具有较高熔点的化学修饰之一,其熔解温度高于野生型核苷,并具有较高的酶稳定性,具有更强的杂交亲和力,强大的反义活性,优异的单错配鉴别能力和低毒性[10-12]。
PNA 是核酸类似物,其结构特点为肽核酸的肽键替代磷酸二酯骨架,含有不带电荷的柔性聚酰胺主链,由核碱基通过亚甲基羰基连接基团连接的重复N-( 2-氨乙基) 甘氨酸单元组成。
这些寡聚体可以与单链或双链DNA 或RNA 形成非常稳定的双链或三链,有良好的结合亲和力和细胞摄取[4,13]。
PNA 不是RNase H 酶或其他RNase 酶的底物,PNA 的反义机制依赖于其空间位阻。PNA 还可以与DNA 结合并抑制RNA 聚合酶的起始和延伸,以及转录因子如核因子κB 的结合和作用。PNA也可以结合mRNA 并抑制剪接或翻译起始和延伸[14]。
PMO 低聚物具有独特的结构,其中DNA 的脱氧核糖部分被六元环吗啉环取代,并且带电的磷酸二酯核苷间键被中性的二硫代磷酸酯键取代。
PMO 类药物的优势在于可在剪接转换和翻译水平阻断这2 个水平上对靶基因进行调控。
此外,PMO的中性骨架可以增强其核酸酶抗性、提高生物利用度以及改善组织或者细胞的选择性分布,细胞对PMO 的内化以特异、可饱和的和能量依赖性特点进行[15]。
第3 代AS-ONs 的临床给药剂量和方案为每周1 ~ 2 次,给药总量大约在每周每人20 ~ 100 mg。综上所述,尽管gapmer 是目前很常用也很有应用前景的第2,3代AS-ONs 治疗剂,包括2'-O-MOEPSgapmer ODN,2'-OMe-PS gapmer ODN,PS-cEt-BNA gapmer ODN,LNA-PS gapmer ODN 等[16],但目前gapmer 对肝脏造成明显不良反应,肝毒性临床标志物谷丙转氨酶和天冬氨酸氨基转移酶显著增加[17],10% ~ 20% 的患者遭受肝损伤[16]。
目前研究表明,gapmer 肝脏毒性问题可能归结于其非特异性沉默活性,即由于LNA gapmer 的低特异性导致脱靶RNA 裂解而引起的[16, 18]。未来可期望通过计算机分析预测,避免使用可能具有脱靶效应的gapmer序列,以及通过化学生物学使用新颖的核苷类似物,以达到显著提高靶序列识别特异性,减少脱靶效应的目的[9]。
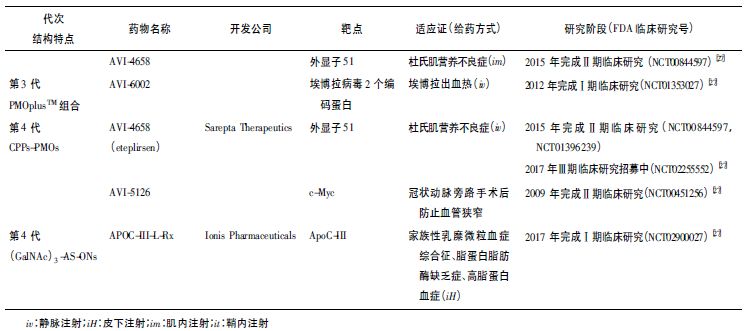
总体而言,基于第2 代和第3 代AS-ONs 在克服系统递送成药性方面已经取得巨大进步。除了在单体水平进行化学修饰,治疗性寡核苷酸与不同生物分子的生物缀合被认为是第4 代AS-ONs[19]。
生物共轭可以通过化学和磷酰胺化反应将肽、脂质、碳水化合物或其他核酸与寡核苷酸结合。阳离子细胞穿透肽( cell penetrating peptides,CPPs) 或者抗菌肽等功能性肽偶联ODNs,可以改善细胞特异性和细胞内递送,提供有效的摄取[4,20-21]。
CPP 主要分为3 类: 阳离子类、两亲类和疏水类。目前代表性的
CPP 主要有转导肽( transduction peptides 又叫内化肽PNA/PMO internalization peptide,Pip 系列肽Pip5e,Pip6a) 、核定位序列( nuclear localization signal, NLS) 、人类免疫缺陷病毒(human immunodeficiency virus) HIV-1 TAT 肽段TAT48-60 等,与PMO或者PNA 偶联[19, 21]。除了CPP-单个AS-ON 的递送,还有双特异性肽-PMO( peptide-PMO,P-PMO) ,即2 个PMO 与单个CPP 缀合,在杜氏肌营养不良的小鼠模型中药效显著[22]。
上述生物偶联肽不仅可以通过靶向性提高药效,也不会积累在特定器官中,此外,与抗体和蛋白质相比,它们较少引起免疫原性[23]。
配体-AS-ON 偶联也是第4 代AS-ONs 药物递送的主要策略[24]。高效配体,三价N-乙酰半乳糖胺( N-acetyl-β-galactosamine,GalNAc) -AS-ON 与单纯AS-ON 相比,体内外药效显著增加[25],证明GalNAc-ODNs 这种新型递送平台在临床开发用于肝脏疾病的治疗的应用前景。
目前第4 代AS-ONs已经有近20 个药物处于临床试验,每周给药1 次或每月给药1 次,每周或月给药总量大约在每人5 ~ 40 mg。第4 代CPP-AS-ONs 处于临床试验阶段。第1 代到第4 代代表性药物见表1。
2
AS-ONs 定量分析与药动学研究
2.1 定量分析技术
用于AS-ONs 药物PK 评价的生物分析方法类型大致分为2 类:色谱分析方法( 直接法) 包括:
① 高效液相色谱紫外/荧光法( high-performance liquid chromatography-UV/Fluorescence,HPLC-UV/FD) 。
② 毛细管凝胶电泳-紫外法( capillary gel electrophoresis-UV,
CGE-UV) 。
③ 液相色谱-质谱联用( liquid chromatography tandem mass spectrometry,LC-MS /MS) 和液相色谱-高分辨率高质量精度质谱( liquid chromatography-high resolution accurate mass,LC-HRAM) 。
基于杂交的分析方法( 间接法) 包括: ① 基于杂交的酶联免疫吸附测定( hybridized enzyme linked immunosorbent assay,HELISA) 和杂交-流式细胞术( hybridized flow cytometry,HFCM) 。② 基于杂交的HPLC-FD 方法。
2.1.1 基于色谱的分析方法
该方法的优点首先体现在高特异性( 序列和结构特异性) 。由于相对分子质量识别、离子碎片特性鉴定、高效液相色谱分离等特点,HPLC-UV,CGE-UV 和HPLC-MS /MS 具有分离原型AS-ONs 与其代谢物的能力。
虽然这些方法适用于体内产生缩短核苷酸代谢物的PS-ASONs,但是它们对于新一代AS-ONs 而言不太重要,因为由MOE,Me 和LNA 修饰的AS-ONs,以及PMO类AS-ONs 代谢稳定性提高,血浆中代谢物非常少( 检测限以下) [41]。
灵敏度方面,该类方法对于血浆基质中原型AS-ONs 的LLOQ 目前可达到5 ~ 15 ng·mL−1,仍略低于HELISA[42 - 43]。此外,HPLC-MS /MS用于AS-ONs 的定量分析方法建立仍具有挑战性,如非特异性吸附、稳定性、液相色谱柱残留现象、电荷分布与金属离子加合物、离子对试剂造成离子抑制等。该类方法更适用于小片段寡核苷酸( ~ 8-18核苷) 。
毛细管电泳技术( capillary electrophoresis,CE)是以毛细管为分离通道、以高压直流电场为驱动力,根据样品中各组分之间迁移速度和分配行为上的差异而实现分离的液相分离技术。
CE 用于AS-ONs定量分析时主要以毛细管凝胶电泳-紫外检测( CGE-UV) 和无胶筛分毛细管电泳-紫外( non-gelsieving capillary gel electrophoresis,NGCE-UV) 为主。
CGE-UV 和NGCE-UV 技术优势为分离效率高,能提供单个核苷酸分离,可以测定体内代谢过程中相差1 个核苷酸的代谢产物[44]。
但由于该方法样品前处理步骤复杂、而一系列样品前处理步骤导致操作通量低、且绝对回收率低,灵敏度低( 生物基质中的最低定量限一般为1 mg·L−1) 、完全不能够阐述低剂量给药条件下末端消除相的血药浓度情况,造成药时曲线信息不完全[45]。
样本前处理方法的不断改进,使其成为一代和二代AS-ONs 药物的临床前和临床PK 研究的主要手段之一,随着质谱技术的发展,CE 结合MS 的联用技术也将成为AS-ONs 定量分析的有力工具。
2.1.2 基于杂交的分析方法
核酸杂交酶联免疫吸附测定: HELISA 在现有方法中灵敏度最高( 可达到pmol·L−1级别) ,样品前处理简单、通量高,是临床前和临床研究中2'OMe 等形式AS-ONs 检测的首选方法。基本原理为利用一个锚定的、3' 端与待测AS-ON 序列互补的俘获探针俘获生物基质中的分析物,通过T4 连接酶将检测探针( 序列与捕获探针5' 端互补,3' 端偶联酶标显色系统) 与上述核酸杂交复合物相连,建立桥接体系。
利用S1 核酸内切酶降解双链核酸中的单链或缺口处切割双链DNA,保证对AS-ONs 药物原型检测的特异性。最终利用检测探针3' 端偶联的酶标显色系统进行信号检测[46]。
由于PMO 在末端缺少-OH 基( 结合检测探针所必需) ,Hong 等[43]将HELISA 改进使之适用于肽-PMO 偶联物( P-PMO) 和PMO 定量分析。
基于PMO 与互补硫代修饰DNA 探针的杂交,探针在两端分别用生物素和地高辛进行标记,其中使用生物素将探针锚定于中性亲和素包被的96 孔板,并且将地高辛用于随后的检测。
使用优先切割单链DNA的微球菌核酸酶( MNase) 区分PMO/探针杂交体与单个探针。
使用与碱性磷酸酶结合的抗地高辛抗体结合荧光强度制备基质中PMO 或P-PMO 的标准曲线来测定样品中AS-ON 浓度。血清和组织裂解物定量范围为5 ~ 250 pmol·L−1,成功完成杜氏肌营养不良小鼠中PMO 和P-PMO 的给药后24 h PK 行为描述[18]。
核酸杂交流式细胞术HFCM: 为进一步阐明PMO 药物发挥作用的物质基础,不仅需要对PMO药物的组织分布浓度进行考察,对于与细胞状态和PMO 摄取有关的特定组织细胞群内PMO 定量分析也非常重要。
Schnell 等[47]开发了基于“夹心杂交”-流式细胞术的概念验证方法来检测PMO,可以检测细胞相关PMO 或PMO 的各种化学修饰,包括P-PMO和PMOplus,方法定量范围为0. 4 ~400 nmol·L−1。
基于杂交的HPLC-FD: 基于杂交的LC 荧光测定涉及2 个关键步骤[48]。首先AS-ONs 与荧光标记的序列特异性探针进行杂交,然后将所得荧光标记的双链体进行强阴离子交换HPLC 分析,由荧光检测器监测。该技术具有HELISA 的优点( 高灵敏度~ 1 ng·mL−1血浆等样品制备简单) 以及常规HPLC-UV/FD 测定的优点( 精确度/精度高,动态范围大,重现性好± 15% ~ 20%,特异度高) ,并且可以不需要内标; 对结构修改没有太多限制,可以很好地耐受寡核苷酸的化学修饰。
基于杂交的分析方法更适用于中等片段长度的寡核苷酸( 14 ~ 30 个核苷) [49]。
此外,核酸杂交体和核酸内切酶对于方法的灵敏度、特异性非常重要。在高盐( > 100 mmol·L−1) 和中性pH 的存在下,核酸杂交体最稳定。此外,通过将DNA 探针的末端替换成硫代修饰骨架,可以使PMO/探针杂交体对切割具有抗性[18]。
S1 核酸酶的特点是对pH 高度敏感,在pH > 4.5 时显著丧失活性。MNase 对pH 变化较不敏感,工作范围为pH 7~10。然而,MNase虽偏爱酶切单链DNA,在较高浓度下也能够切割双链DNA[46]。
总体而言,对探针和核酸酶的修改有助于更加提高该类方法的性能。综上所述,用于表征AS-ONs PK 行为的生物分析方法的选择取决于寡核苷酸分子的长度和化学修饰[42 - 43, 50 -51]。通常,寡核苷酸的片段长度增加导致色谱分析方法的灵敏度降低,对比之下,基于杂交的方法灵敏度增加。
因此,前者对于分析小寡核苷酸分子有利,而后者优选用于分析相对较大的寡核苷酸分子。
基于杂交的HPLC-FD 与HELISA 测定灵敏度相当,前者具有更宽的动态范围( 高达3 个数量级) ,更高的重现性,正在越来越多地被用于寡核苷酸治疗剂的生物分析。通常,整个药物的研发过程中,需要多种定量分析方法完成PK 评价。2016年FDA 批准上市的nusinersen 药物的临床前和临床药动学评价中,就用到了CGE-UV,HPLC-UV,LCMS/MS 和HELISA 4 种方法[50 - 51]。
除了上述方法,微流控液相色谱-质谱、自动/整合的固相萃取-液相色谱-串联质谱、LC-HRAM 将在寡核苷酸生物分析和代谢物鉴定方面有更多应用的报道[41, 52]。
2.2 AS-ONs 的药动学
PS-ODNs 的PK 性质主要受到化学修饰影响,与序列无关[53]。
肠胃外系统给药后,PS-ODNs 多呈非线性血浆药动学特征,迅速吸收并广泛分布于组织中,以肾皮质和肝脏中药物浓度最高。PS-ODNs由核酸酶代谢而非细胞色素P-450 酶。
PS-ODNs 在外周血的降解主要由3' 核酸外切酶依次单碱基切割产生n-x 小片段,且代谢迅速,静脉输注5 min 可以观察到30% ~ 40% 的原型药产生n-1 代谢物,血浆半衰期通常0.5 ~ 1 h。组织内3'-,5 '-核酸外切酶均可以参与代谢,以前者为主。
内切酶介导的代谢并不常见,但是功能基团经过修饰免受核酸外切酶切割时可以呈现内切酶代谢特征,即代谢物以若干片段为主而非n-1 依次递减。PS-ODNs 依赖于不同的序列特征进入细胞并呈现不同的亚细胞分布模式。
胞饮作用或细胞吞噬作用被认为是细胞摄取的潜在机制。肝脏( 枯否细胞) 、骨髓( 成纤维细胞) 和肾脏中的清道夫受体等通过吞噬作用从血液中消除PS-ODN[54]。PS-ODNs 主要以原型或者小片段形式经肾排泄。
PS-ODNs 经皮下,腹膜内和皮内给药途径与静脉途径相比,除血浆峰浓度较低外,血浆清除曲线非常相似。PS-ODNs 极容易与血浆蛋白,如白蛋白和a2 巨球蛋白发生低亲和力的非特异性结合,这种与血浆蛋白的所谓的“黏性”,可以大大减少肾清除,具有良好的组织分布和较长半衰期,但是与血浆蛋白的结合限制了其功能性摄取吸收,同时也对是凝血和补体系统产生非特异性影响的原因[54]。
与PS-ODNs 相比,2'-MOE,2'-OMe 修饰以及2'-O-MOE-PS gapmer ODN 和LNA-PS-ODN 具有高溶解度( 在中性和碱性条件下) 、亲水性和低肠通透性( 大小20-mers 约为7 kDa) ,肠胃外系统给药后的临床PK 性质非常相似,具体表现为
① 药物进入循环系统后,通过与细胞表面蛋白相互作用和内吞作用被组织广泛和快速摄取,之后在组织内经由核酸酶介导代谢,因此血浆半衰期较短( 以h 为单位) ,组织末端消除半衰期较长( 以周为单位) ,重复给药后,由于迅速分布于组织,因此血浆峰浓度( peak concentration,Cmax) 或总曲线下面积( area under curve,AUC) 并未显著增加。
② AS-ON 原型药物与血浆蛋白高度结合( > 90%) ; iH 途径给药后生物利用度高( 接近绝对生物利用度) 。
③ 第2 代AS-ON不是p450 氧化代谢的底物[55],而是通过核酸酶代谢[42, 56]。gamper DNA 两翼的2'-O-MOE 和2'-OMe修饰保护AS-ONs 不被外切核酸酶代谢,酶切一般始于核酸内切酶对DNA 中枢区域的酶切,产生2 个较短的ODN 序列,均含有具有受保护的末端和未被保护的末端。未受保护的ODN 末端继续被核酸外切酶切割,产生更短的寡核苷酸代谢片段。由于代谢物形成速度慢,与血浆蛋白质( 组织蛋白) 结合率低,因此短链ODN 代谢物不会积聚在血浆或组织中,而是通过尿液迅速消除( 主要为7 ~ 14 mer 的ODNs 代谢物) ,血浆中测不到代谢物[42, 51]。
④ 新一代AS-ON 的代谢主要通过原型在组织内缓慢产生的链缩短的代谢物,通过肾消除从尿液排泄。临床试验中,给药后1 d 内的总寡核苷酸( AS-ON 原型加代谢物) 的尿排泄量与给药剂量相比,通常<10%,其余的( > 90%) 原型药物广泛分布到组织中。肾脏、肝脏和脾脏中药物浓度最高。
⑤ 第2 代AS-ON 与血浆蛋白质( 主要是白蛋白,还有许多其他
血浆蛋白质) 高度结合,然而第2 代AS-ON 的临床Cmax远低于血浆蛋白如白蛋白( ~ 0.6 mmol·L−1) ,因此几乎不会发生结合饱和。此外,寡核苷酸与血浆中蛋白质的亲和力相对较弱( Kds~μmol·L−1) ,这些亲水药物的结合位点与低相对分子质量疏水药物的结合位点不同。因此目前未见基于代谢的( 或基于蛋白质结合的) 药物相互作用[51]。
第2 代AS-ON上述这些PK 性质的相似之处和物种间PK 行为的差异性小,且不依赖于靶标选择,基于对于剂量方案对应PK 的可预测性,极大加速了新一代AS-ONs 的研发速度。
与PS-ODNs 不同,PMO 的PK 特征明显依赖于序列[53]。大多数PMO 在给药后血药浓度快速下降,并迅速( 24 h 内) 分布到组织。组织中浓度水平依次为肾脏和肝脏、脾脏、肺、心脏、骨骼肌和胸腺等。
由于PMO 的中性电性导致血浆蛋白结合差,因此肾消除占总血浆清除率的64%,该值远高于PSODNs[57]。虽然PMO 主要在尿液中消除,但对于某些序列,也能测到经粪便排泄。
临床前PK 研究表明,PMO 对酶降解稳定,甚至在6 个半衰期后也可以在组织中检测药物原型[58]。在血浆或尿液中,未发现代谢物[53]。PMO 目前最大的挑战是入胞困难,PMOplus 和P-PMO 是增加其入胞常用的2 种策略。P-PMO 具有比PMO 更好的PK 特征,P-PMO 清除率与PMO 相比较低,静脉内施用AVI-6003( PMOplus)的血浆消除半衰期与PMO 相当,约为2 ~ 5 h,
但均稍短于P-PMO[59 - 60]。
AUC 暴露水平比PMO高3 倍,从而达到最佳的组织摄取。肽缀合有助于将PMO 递送到所有组织,尤其肝摄取显著增加,P-PMO 在肝脏中的分布比PMO 高130 倍[18]。
PMO不能通过血脑屏障,但是有限的研究对于P-PMO 是否能通过血脑屏障入脑尚存争议,荧光素异硫氰酸酯标记的P-PMO 显示小鼠模型中脑部有P-PMO 分布[61],但不能排除是由于FITC 标记的肽体内被代谢切割,穿过血脑屏障在脑组织中分布,而不是完整的P-PMO。HELISA 方法在动物模型中则显示PPMO可以透过血脑屏障,但是PMO 不能[18]。因此P-PMO 是否能透过血脑屏障有待于进一步验证。
3
结语
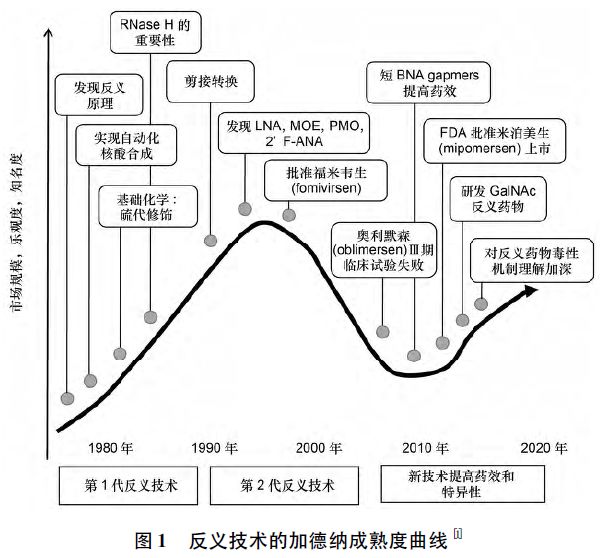
药效、药动学特征和毒性对AS-ONs 成药性均有决定性影响。伴随递送系统和化学修饰技术的推动,AS-ONs 药物已经基本实现系统给药形式( iv 和sc) ,此外还可实现鞘内递送以治疗各种中枢神经系统疾病,皮内递送用于伤口愈合,吸入治疗用于治疗哮喘和其他肺部疾病,甚至口服给药等。AS-ONs药物经历了加德纳技术成熟曲线的变迁( 见图1) ,随着组织和细胞内的有效摄取,gapmer 等肝毒性等问题的攻克,将极大推动AS-ONs 药物的研发,2016 年2 种AS-ONs 药物FDA 获批,这可能预示着未来AS-ONs 在基因治疗领域将逆袭,继续占领重要地位。
参考文献
详见原文,中国新药杂志 2018 年第27卷第21 期