胰腺癌因发病率和死亡率双高而被称为“癌王”,且近年来在世界和中国范围内的发病率都有明显增多的趋势。遗憾的是,到目前为止仍未找到有效的治疗手段。众所周知,癌细胞存活在增殖和生长中需要大量的能量供应。近日发表在《Nature》上的一项研究发现了一种“饿死”胰腺癌肿瘤的新方法。该研究由美国德克萨斯大学MD Anderson癌症中心的研究人员完成。
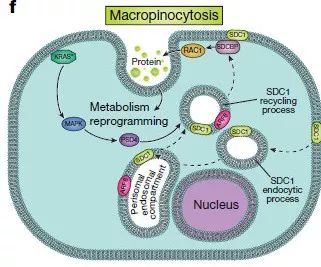
该方法由该研究通讯作者、首席科学家和基因组医学教授Giulio Draetta博士开发,它能被用于追踪胰腺癌细胞,以了解癌细胞是如何重新排列其表面的蛋白质。这一发现揭示了一种名为syndecan-1 (SDC1)的蛋白质,它会根据KRAS突变发出的信号移动到细胞表面。KRAS是一种已知存在于90%以上胰腺导管腺癌中的蛋白质。
该研究进一步解释,SDC1在细胞表面的定位是胰腺癌细胞增强巨胞饮作用的关键。巨包饮是细胞摄取营养物质及其它液相大分子的特殊途径,参与免疫反应、病原菌侵袭等重要生物学过程。近年来发现癌细胞可以通过巨胞饮的方式摄取胞外蛋白质及脂类代谢产物作为营养来源,而阻断胞饮作用可抑制肿瘤生长。
尽管KRAS突变在胰腺癌中激活巨胞饮作用早已被证实,但控制这一过程的分子机制仍不明确。Draetta团队提供的证据表明,SDC1响应来自KRAS的信号,从而在细胞表面积聚并诱导该途径。
Draetta说:“到目前为止,对巨胞饮作用的药理抑制还没有完成。我们发现,在KRAS驱动的胰腺癌中,SDC1在调节巨胞饮方面起到关键作用,这值得我们进一步探究靶向SDC1的治疗手段。”
图片来源:《Nature》
癌症与细胞表面
细胞表面(或叫表面体)是动态的,细胞膜随着来自细胞和外部环境的信号而移动。在癌细胞中,基因突变会强加给细胞指令,让它们优先选择支持其不受控制生长的途径。
研究人员,详细理解KRAS突变如何重新定义细胞膜功能的优先级,将揭示出关于胰腺癌细胞生存途径的关键细节。
Draetta说:“很多致癌过程都是在细胞表面开始的,KRAS在细胞表面从物理和功能上与恶性转化和肿瘤维持所必需的直接信号相互作用。直到现在对胰腺癌表面小体复杂性的认识仍然存在着技术上的局限性。在KRAS信号传导的情况下,胰腺癌表面组的功能和组成的遗传控制仍然很大程度上仍未被探索。”
图片来源:《Nature》
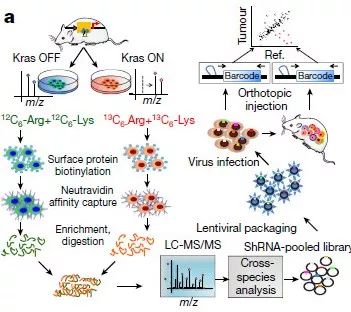
因为KRAS突变在胰腺导管腺癌(这种恶性疾病的5年存活率只有8%)中非常频繁,研究人员设计了一种方法来研究胰腺癌模型中的细胞表面,在该模型中KRAS可以开启或关闭。
研究人员发现,细胞表面的蛋白质在响应KRAS表达时会发生显著变化,而SDC1是在KRAS表达时最丰富的蛋白质之一。这是KRAS指示SDC1穿过细胞在表面完成其工作的第一个直接证据。通过使用不同的方法来阻止SDC1整合到细胞膜上,即使SDC1可能存在于细胞内,它也只会在细胞吞噬细胞表面时上调微小细胞增多症。
尽管理解了KRAS在维持胰腺癌细胞存活方面的重要性,但研究人员仍然很难以KRAS为靶点。目前临床上没有可以充分关闭KRAS信号杀死癌细胞的药物。了解SDC1在KRAS的控制下为胰腺癌细胞提供能量,可能使具有这种侵袭性突变的肿瘤能够通过靶向SDC1进行治疗,而SDC1在细胞表面的存在可能使其更容易受到治疗干预。
Draetta说:“我们认为,细胞表面是一个令人兴奋的地方,因为可以寻找更多线索了解癌细胞与正常细胞的根本区别。目前,针对SDC1的单克隆抗体正在对多发性骨髓瘤进行检测,这一科学步骤可能为胰腺癌的类似治疗开辟临床研究。”
Syndecan 1 is a critical mediator of macropinocytosis in pancreatic cancer
https://www.nature.com/articles/s41586-019-1062-1
来源:中国生物技术网2019-04-01