说起药物研发,大家都知道是个费时费力,历经波折,大浪淘沙的过程。
今天和大家分享的是一个从家族遗传学疾病作为起点最终成功研发出临床应用药物的有趣故事。
近年,随着PCSK9(前蛋白转化酶枯草溶菌素Kexin9)抑制剂类药物的两项大规模心血管预后研究结果的公布,这类药物降低低密度脂蛋白胆固醇(LDL-C)以及降低动脉粥样硬化性心血管疾病(ASCVD)患者心血管事件再发风险的显著疗效,获得了广大临床医生的认可。
首个在中国获批的PCSK9抑制剂——依洛尤单抗,也为合适的纯合子型家族性高胆固醇血症(HoFH)患者以及ASCVD患者提供了更先进的治疗手段。
说到依洛尤单抗的研发,要从2003年Seidah等人发现了前蛋白转化酶家族的第九个成员,也就是PCSK9谈起。
同年,Abifadel等人首次报道在两个法国家庭中的PCSK9功能获得型突变,从而发现了PCSK9在调控胆固醇代谢方面的作用。
在此之后,又有多个研究发现,PCSK9功能获得型基因突变与高胆固醇血症、冠心病、早发心肌梗死和卒中具有相关性。而PCSK9功能缺失型基因突变与较低的LDL-C水平和冠心病风险相关。
同时,对于PCSK9基因突变导致极低LDL-C水平的人,虽然LDL-C水平长期处于极低状态,但却未影响其健康状况或智力发育。
这提示,将PCSK9作为靶点进而干预LDL-C的可能性。
前期研究后发现,PCSK9虽然从蛋白序列上看,是一个地地道道的蛋白酶,但却没有蛋白酶活性,这就让聪明的科学家们意识到,PCSK9的作用似乎不是通过蛋白酶活性发生的。
在2007年,安进公司(Amgen)的科学家们在全世界范围内,第一次解析并且报道了PCSK9的晶体结构包括前功能区,催化区和腱蛋白区。PCSK9通过其催化区部分与LDL受体以分子伴侣相互结合(而非酶的活性)的形式发挥其后续对LDL代谢的影响。
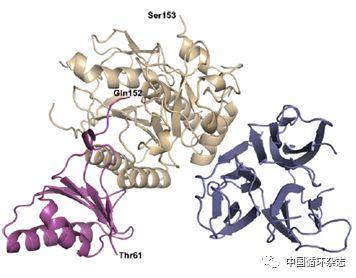
综合之前PCSK9在调控胆固醇水平方面的发现,科学家们了解到PCSK9可以在细胞内经过自我处理,分泌到血浆中。PCSK9与肝细胞表面的LDL受体(LDLR)结合,后者又与循环中的LDL结合,经过内吞作用,从肝细胞表面转到肝细胞内部。
在肝细胞内部,LDL颗粒与结合了PCSK9的LDLR都会被溶酶体降解,这就直接使得LDLR不能够返回到肝细胞表面继续清除血浆中LDL颗粒,从而造成了血浆中LDL-C的水平升高。
由于发现了PCSK9调控LDL-C水平的机制,使得将其作为一个治疗靶点,生产出抗体类药物对其进行抑制成为可能。
科学家们基于生物学方面的理解将阻断PCSK9与LDR的结合作为抗体药物筛选和分析的方向。
当然,进行抗体药物的研发,是一项极大的挑战,不仅要找到最佳的抗原表位,使抗体对于抗原有更强的亲和性,同时也需要筛选出对于靶点高特异性的抗体,也就是抗体药物需要同时具备高亲和力和高特异性。
另外,通过完善抗体药物的理化性质,尽可能减少抗体药物的免疫原性,使其不产生中和抗体,也都是生物技术上的难关。
最终通过大量临床前和临床研究,安进科学家和临床医生的共同合作,通过XenoMouse®平台发现和生产的全人源单抗——依洛尤单抗,展现了可靠的疗效和安全性,并于2015年7月作为PCSK9抑制剂这类药物,在全球范围内第一个获得监管机构(欧洲药品质量管理局)的批准。
作为单抗类药物,依洛尤单抗具有高度的特异性。同时,依洛尤单抗体内消除并不通过肝脏或肾脏的代谢途径进行,这也使其对于患者的基础肝肾功能依赖性较小。
今天通过介绍依洛尤单抗的研发故事,希望能让大家了解新药研发的偶然性和必然性,以及在研发过程中大量科研人员和临床医生不懈的努力和严谨的科学实践。
AMG_Repatha_CN_2019_05_032
参考文献
[1] J Lipid Res, 2012,53(12): 2515-2524.
[2] Cardiovasc Res,2016, 112:429-442.
[3] Nat Genet, 2003, 34(2):154–156.
[4] Structure, 2007, 15(5):545-552.
[5] Clin Chim Acta, 2014,431: 148-153.
[6] J Mol Neurosci,2014, 53(2): 150-157.
[7] N Engl J Med, 2006,354(12):1264-1272.
[8] Am J Hum Genet, 2006,79(3): 514-523.
[9] Atherosclerosis,2007,193: 445-448.
[10] Proc Natl AcadSci U S A, 2003, 100: 928-933.

