溶瘤病毒疗法是一种直接作用于肿瘤细胞的治疗方法,其原理是对天然存在的致病力较弱的病毒进行基因改造形成溶瘤病毒(Oncolytic virus,OV),利用癌细胞中畸变的信号通路(如抑癌基因失活或缺陷)选择性在肿瘤细胞中复制,导致肿瘤细胞裂解与死亡。
一、溶瘤病毒的作用机制
溶瘤病毒发挥对肿瘤细胞的杀伤作用主要通过以下途径:(1)直接裂解肿瘤细胞;(2)病毒感染的肿瘤细胞表达相关信号并释放大量细胞因子造成免疫细胞对肿瘤细胞浸润;(3)裂解的肿瘤细胞释放特异性抗原和免疫相关因子,诱发机体产生抗肿瘤免疫反应;(4)溶瘤病毒可以作为载体携带肿瘤抑制基因、促凋亡基因、抗血管生成基因、自杀基因和免疫调节基因,调控肿瘤免疫耐受微环境。
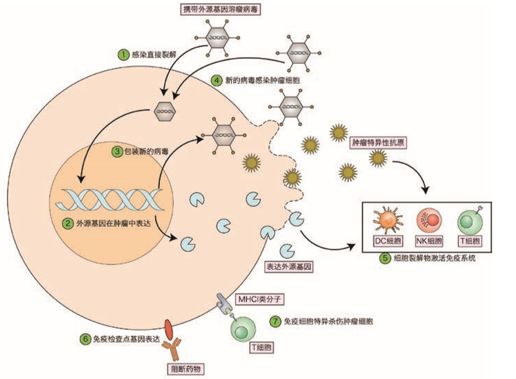
图1 溶瘤病毒参与肿瘤细胞杀伤的途径
二、历经百年发展,基因重组技术和肿瘤免疫联合治疗助溶瘤病毒重焕生机
溶瘤病毒的发展大致可分为野生病毒株发现应用阶段、基因改造病毒株研发阶段和基因插入及联合治疗增效阶段三个阶段。
1. 第一阶段:1904—1990年,野生病毒株发现应用阶段
溶瘤病毒在临床上的探索和尝试始于19世纪末20世纪初,与病毒几乎同时发现,期间陆续有关病毒感染的肿瘤患者的病情缓解或痊愈的零星报道,并诞生了溶瘤病毒概念及相关研究。
随后研究人员利用变异后的天然弱病毒株进行溶瘤治疗,水痘病毒、麻疹病毒等野生型病毒或减毒毒株短期内展现出一定的抗肿瘤效果,但天然溶瘤病毒对肿瘤细胞杀伤能力有限,易激活宿主免疫系统被清除掉,研究人员难以有效控制病毒病原性。80年代初有效的化疗药物的崛起后,溶瘤病毒研究步入低谷。
2. 第二阶段:1991—2010年,基因改造病毒株研发阶段
现代溶瘤病毒发展始于20世纪90年代,分子生物学和生物技术的发展使得重组病毒基因组改造技术逐渐成熟,溶瘤病毒在溶瘤效果、安全性及特异性方面都有了显著进步。1991年,人类首次对单纯疱疹病毒1型(HSV-1)进行胸苷激酶(Thymidine kinase , TK)敲除基因改造,癌症的溶瘤病毒治疗开始突飞猛进。1996年,基因改造的腺病毒ONYX-015进入I期临床试验。
图3 溶瘤病毒技术发展历程
图片来源:Nature、浙商证券
2003年,重组腺病毒-p53抗癌注射液(今又生)获得原CFDA批准,成为世界上首个获准上市的基因治疗癌症药物;2004年,非致病性的人肠道细胞病变孤儿病毒(enteric cytopathic human orphan virus)--RIGVIR,在拉脱维亚获批用于治疗黑色素瘤。2005年,重组人5型腺病毒注射液(安科瑞)在中国获批上市,但这些产品的临床疗效并未得到国际认可。
3. 第三阶段:2010年-至今,溶瘤病毒提效阶段
2015年10月,FDA批准携带人粒-巨噬细胞集落刺激因子(GM-CSF)的重组单纯疱疹病毒产品T-vec(Talimogenelaherparepvec, Imlygic)上市,2016年T-vec又分别在欧洲和加拿大获批上市,标志溶瘤病毒技术的成熟和对溶瘤病毒治疗癌症的正式认可。
2017年9月,《CELL》报道溶瘤病毒T-VEC与PD-1抗肿瘤药物Keytruda联合用药用于黑色素瘤,肿瘤缓解率高达62%,其中33%为完全缓解,掀起了溶瘤病毒免疫联合疗法研究的热潮。
三、溶瘤病毒以腺病毒、HSV-1(单纯疱疹病毒)和痘苗病毒临床应用较为广泛
目前在Clinical临床试验网站注册的溶瘤病毒主要有:腺病毒、柯萨奇病毒、HSV-1(单纯疱疹病毒)、麻疹病毒、新城疫病毒、呼肠孤病毒、水泡型口炎病毒、痘病毒、脊髓灰质炎病毒等,以腺病毒、单纯疱疹病毒和痘苗病毒临床应用最为广泛。其中由于腺病毒基因重组以及生产比较容易,因此临床开发广,试验开展最多,而HSV-1(单纯疱疹病毒-1)和痘苗病毒等因其基因组比较大,可加入任意的外来基因,在基因治疗上有很大优势,应用前景广阔。
表1 临床常用溶瘤病毒种类优缺比较
四、科研院所及其团队助力我国溶瘤病毒产业发展
在溶瘤病毒研发方面,我国曾走在世界前列。2005年,重组人5型腺病毒注射液(安科瑞)在我国上市,早于安进T-vec上市近10年之久,但因为种种原因没有在临床上得到广泛的应用。
目前我国涉足溶瘤病毒的企业约40家,并有多家企业进行了IND申报,相关代表公司有上海三维、武汉滨会、北京奥源和力、深圳复诺健、深圳亦诺微医药等。
表2 溶瘤病毒相关产品申报
在我国溶瘤病毒发展过程中,国内科研院所教授及其团队在当中发挥了不可忽视的作用:
1. 刘新垣院士及其团队
2001—2003年,刘新垣院士在国际上首次提出“癌症的靶向基因―病毒治疗”(Cancer Targeting Gene-Virotherapy, CTGVT),其原理是将抗癌基因加入到溶瘤病毒 (OV),其领衔的上海元宋生物技术有限公司成功开展了抗癌药物“重组人肿瘤靶向基因-病毒(ZD55-IL-24)注射液”的临床前研究。
2. 中山大学颜光美教授团队
中山大学颜光美教授在2014年10月6日在国际学术期刊PNAS上首次发表论文简述了M1病毒的由来及作用,此后颜教授团队进行了M1病毒安全性和有效性后续研究,并发现了M1病毒靶向杀伤癌细胞的标志物,目前溶瘤病毒M1已启动第三方安全评价,预计将于2019年进行人体临床试验。
3. 上海交通大学蔡宇伽教授团队
蔡宇伽教授及其领衔的本导基因将最先进的基因编辑、合成生物学开关调控等生物学技术引入溶瘤病毒研发管线,其核心技术包括:(1)利用CRISPR全基因文库技术筛选候选因子;(2)利用合成生物学开关调控基因表达,保证溶瘤病毒安全性与有效性;(3)与免疫检查点抑制剂联合提高抗肿瘤疗效。
4. 刘福生教授团队
北京市神经外科研究所、北京天坛医院神经外科刘福生教授团队主持研发了一种新型的溶瘤病毒ON-01,其中是由野生型的病毒通过基因工程进行基因改造,删除了该病毒对神经细胞的毒性基因及该病毒中的DNA合成酶,使其利用肿瘤细胞的这些DNA合成酶,选择性地在肿瘤细胞内繁殖并生长并扩散。目前,ON-01用于复发高级别脑胶质瘤正处于临床I期。
5. 周国瑛教授团队
周国瑛教授是广州医科大学中法Hoffmann免疫研究所2013年10月从美国芝加哥大学引进的全职PI、特聘教授。周教授被誉为国际上疱疹靶向溶瘤病毒的发明人,2006年在国际上成功报道改变疱疹病毒的天然细胞入侵途径,使之精确靶向恶性脑瘤。除了继续在疱疹病毒感染与免疫的基础理论领域研究外,周国瑛教授在2015年注册成立深圳亦诺微生物医药科技有限公司,已领导完成溶瘤病毒免疫治疗系列产品的研发,相关产品研究进入澳洲临床研究(Phase I)阶段。
五、我国溶瘤病毒产业发展面临挑战
1. 溶瘤病毒给药途径限制其临床应用
目前,溶瘤病毒以瘤内注射为主,多于用体表肿瘤或部位局限肿瘤,限制了其临床应用范畴。系统性给药(如静脉注射)更有临床应用前景和商业价值,有望治疗转移性肿瘤或血液肿瘤。
但静脉给药存在易被血液稀释,降低裂解肿瘤细胞的疗效;易被循环血液的成分干扰,导致溶瘤病毒失效或被快速清除;易引起全身扩散,导致严重的非靶向性感染等缺点。
2. 溶瘤病毒的上游创新环节面临挑战
病毒种类和功能基因的选择及改造是溶瘤病毒的源头创新环节,但溶瘤病毒常用的病毒种类和插入的功能基因已被大量科研文献广泛发表,这对于溶瘤项目的创新性和专利壁垒会产生相关挑战。
3. 溶瘤病毒产业化应用仍任重道远
溶瘤病毒制备技术基本成熟,但大规模产业化依然有待解决,临床应用级别的病毒载体工业化生产面临多个挑战:
(1)缺乏高灵敏度的活性病毒 GMP 工业生产的质控检测体系;(2)目前仍没有针对临床使用溶瘤病毒的制造和表征的具体监管指南;(3)传统用于实验室目的的贴壁细胞系统在规模放大中会面临很多困难;(4)病毒纯化耗时长,生产成本高等。




