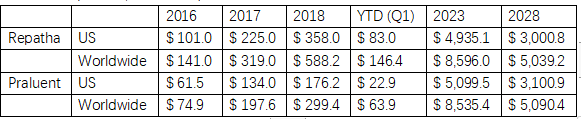文 | 二毛博思
麦迪逊医药拥有来自ALNY授权的Inclisiran,而该药物有望成为动脉粥样硬化性心血管疾病(ASCVD)治疗领域的重磅药物。鉴于此,公司具有较大可能被巨头收购。MDCO的Inclisiran到底价值几何,与已获批药物的相比有什么特别之处,本文试图揭晓答案。
1
投资要点
The Medicines Company(MDCO)当前唯一之前的研发管线为授权自ALNY的siRNA药物Inclisiran,Inclisiran有望成为动脉粥样硬化性心血管疾病(ASCVD)治疗领域的重磅药物。MDCO拥有的Inclisiran权益当前最保守的价值为24亿美元。
截至2019年3月31日,公司共有现金2.02亿美元。公司在6月26日进行了增发,增发价33美元,合计募资金额1.725亿美元(扣除费用前)。
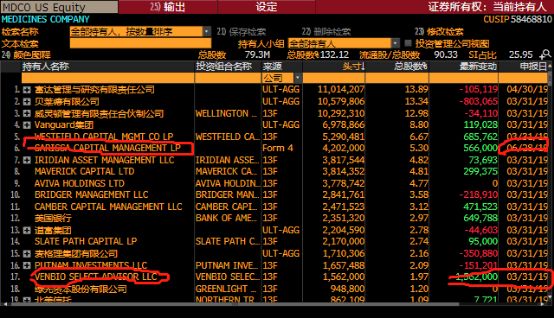
公司大股东Sarissa Capital在6月增持了MDCO,Venbio也增持了公司股票。
公司将于Q3发布三项临床III期试验Topline数据,主要及次要临床终点均为替代性终点(LDL-C、ApoB、PCSK9等),之前的II期试验发布过此类数据,预计不会有太多意外。该试验届时已进行510天,有可能会发布CVOT方面的数据,考虑到PCSK9单抗药物的良好数据,预计CVOT数据不会难看(若难看,公司应该会选择在Phase III - ORION-4的数据发布时再发布)。因此,发布数据后,股价极有可能上涨。
公司的药物为重磅药物,具有较大的被收购可能,收购对象可能为辉瑞。但考虑到基于CVOT的Label Expansion时间最快可能要到2023年,收购举措可能不会太早发生。(收购传闻如AMRN)
The Medicines Company(MDCO)是一家总部位于新泽西州的生物制药公司。公司拥有siRNA药物Inclisiran80%的全球权益,Inclisiran有望成为动脉粥样硬化性心血管疾病(ASCVD)治疗领域的重磅药物。
Inclisiran用于Dyslipidemia / Hypercholesterolemia
2
疾病介绍
血脂异常是一类较常见的疾病,是人体内脂蛋白的代谢异常,主要表现包括总胆固醇和低密度脂蛋白胆固醇(LDL-C)、甘油三酯升高和/或高密度脂蛋白胆固醇降低等。LDL-C被称为坏的胆固醇,是高胆固醇血症治疗时的重点调控指标之一。
根据WHO和CDC的数据,全球每年共有1730万人死于心血管疾病(CVD),其中美国为85.4万人;更有效的LDL-C管理能减少约50%的死于动脉粥样硬化性心血管疾病的人。
3
竞争分析(在研药物列表见database-Dyslipidemia)
用于血脂异常的已获批和在研药物众多,在BMT数据库能找到的该适应症下共有192条研发记录,已进入临床阶段或获批(包括海外)的记录共93条。不同类型的降脂药物作用机制不同,根据Inclisiran的作用机制和适用范围,主要关注与Inclisiran存在直接竞争关系,即,适应症含高胆固醇血症,而作用机理上能降低LCL-C的药物。
与已获批药物的竞争分析
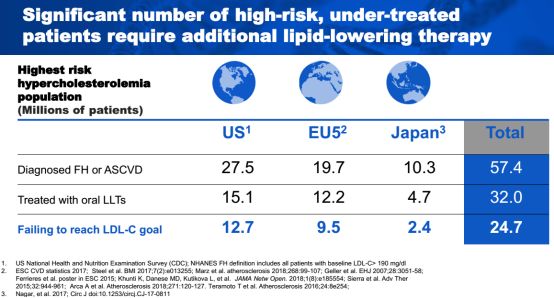
最常用的药物为他汀类药物和依折麦布等。这些药物为口服给药的短效药物,因专利到期而价格低廉(年平均花费仅约为300美元)。但是根据一份早期的数据,目前约有80%的服用他汀类药物的患者没有达到LDL-C<70mg/dL的目标。
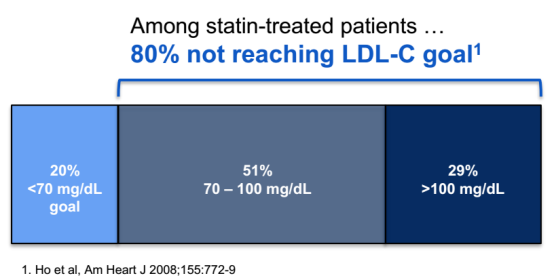
图1 :来源:Company presentation
而在5740万已诊断为家族性高胆固醇血症(FH)或ASCVD的患者中,美国、EU5和日本共有2470万的病人未能达到LDL-C<70mg/dL的治疗目标。在美国和EU5,未能达标的患者比例高达46.2%和48.2%。
图2
导致未达标的药物相关原因主要包括两点。一是短效药物(需长期服用)的患者依从性较差。43%到67%的患者一年后不能坚持治疗方案。只有5%的患者在5年后仍然坚持治疗。不遵医嘱会导致心脏事件风险增加4倍,心脏死亡风险增加2倍。
其二,有部分病人无法耐受他汀类药物的副作用(肌肉事件和肝脏副作用),因而使用可耐受的最高剂量的他汀类药物及其它常用降脂药物均无法有效地控制病情。
作用于PCSK9的药物被认为可提高患者依从性也可用于不耐受他汀类药物病人的治疗。PCSK9,全称前蛋白转化酶枯草溶菌素 9型,被认为是新发现的最可靠的降脂药物靶点。目前已有两款PCSK9的单克隆抗体药物获批,即安进的Repatha和再生元的Praluent。这种单抗药物可结合PCSK9,从而减少PCSK9与LDLR的结合,提高肝脏清除LDL-C的能力,降低血液中LDL-C的水平。根据Repatha和Praluent的试验数据,PCSK9单抗药物亦能显著降低心血管疾病患者的多种心血管事件发生(见下文临床结果比较)。
Inclisiran为靶向PCSK9基因的siRNA药物,可有效减少PCSK9的表达,从而最终达到降低LDL-C水平的目的。
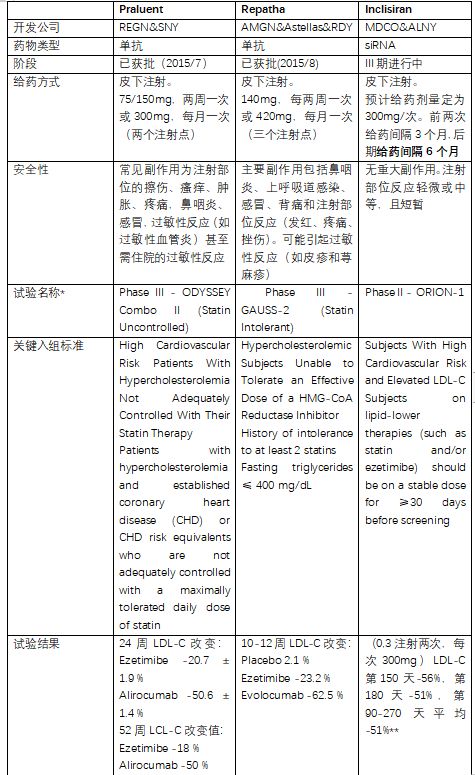
图3:临床结果比较1(试验结果部分仅选择替代终点LDL-C)
*仅选取可比较的临床数据。药物的临床试验设计不完全相同,入组标准的细节披露不充分,绝对数值相差不大时认为差异不大。
**Inclisiran后期给药为半年一次,有人质疑其在两次给药期间对LDL-C的下降幅度有所减弱,但公司电话会议上著名的KOL之一John Kastelein博士说,LDL-C的降低水平百分比有细微变化时,在LCL-C的绝对值上是很小的。
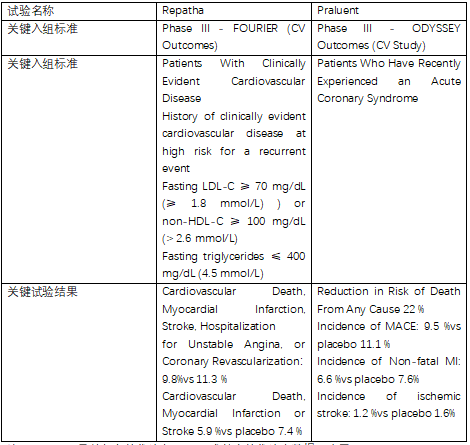
图4:临床结果比较2(CVOT)
注:Inclisiran目前仅有替代终点LDL-C或其它替代终点数据,尚无CVOT。
很难直接比较PCSK9单抗的CV影响的差别,但单抗药物对于中风、心肌梗塞等指标上均显示有明确的效果。
图5:Praluent和Repatha的获批时间表(在获批上均分步进行)
4
产品价格
Praluent原价~$14,664/year,Repatha 原价$14,100/year。安进和再生元(REGN)均已完成产品降价。根据Drugs.com的数据,Praluent当前价格为478.2美元/四周,Repatha当前价格为243.4美元/两周(注仅对比两周一次的剂型价格),二者价格相当。按照一年52周计,Praluent和Repatha年花费分别为6216.6和6328.4美元。
图6:销售表现(销售额,百万美元),来源:Datamonitor数据库
在定价方面,Praluent和Repatha相当。Praluent虽然是最早获批的PCSK9单抗药物,但早期获批的适应症窄于Repatha,后期拓宽适应症的进度也偏落后。这或许是Praluent销售情况落后于Repatha的主要原因。
Inclisiran成功的市场化也必须基于合理的适应症开发。Inclisiran当前已设计了5项临床III期试验。
Phase III - ORION-10 (US),为全部在美国进行的III期临床试验,受试者总人数1500+,患者患有动脉粥样硬化性心血管疾病(ASCVD)合并LDL-C升高。将于2019年Q3发布Topline数据。
Phase III - ORION-11 (EU),受试者为ASCVD及ASCVD-risk equivalents (symptomatic atherosclerosis, Type 2 diabetes, familial hypercholesterolemia, including subjects whose 10-year risk of a cardiovascular [CV] event assessed by Framingham Risk Score (by Framingham Risk Score >20%) or equivalent has a target LDL-C of < 100mg/dL),试验地点包括英国、乌克兰、德国、波兰、捷克和南非,受试者总人数1500+。将于2019年Q3发布Topline数据。
此外还有两项III期临床试验,用于家族性高胆固醇血症。将于2019年Q3发布数据的是Phase III - ORION-9 (Heterozygous FH Subjects, HeFH subjects)。还有一项纯合子FH(HoFH)(最难治的一类,患者人数较少)的临床试验Phase III - ORION-5 (Homozygous FH Subjects),2019年2月刚启动试验。(在HoFH的II期试验中,一名患者(patient A)的PCSK9和ApoB降低明显,但对LDL-C无影响,后期需关注。)
最后,还有一项长期跟踪的III期临床Phase III - ORION-4,受试者为ASCVD患者,预计将招募15000人。2018年10月启动临床试验。
将于Q3公布的三项临床III期试验主要及次要临床终点均为替代性终点(LDL-C、ApoB、PCSK9等),之前的II期试验发布过此类数据,预计不会有太多意外。该试验届时已进行510天,有可能会发布CVOT方面的数据,考虑到PCSK9单抗药物的良好数据,预计CVOT数据不会难看(若难看,公司应该会选择在Phase III - ORION-4的数据发布时再发布。)
根据Praluent和Repatha的审批经历,Inclisiran获批最大的适应症人群将发生在ORION-4试验结果出来之后,预计快的话将在2023年(参考Repatha),慢的话将会在2025年(参考Praluent)。
5
在研药物的竞争分析
ETC-1002(bempedoic acid)是ESPR正在开发的一种口服小分子降脂药,可抑制脂肪酸和胆固醇的合成,促进脂肪酸的氧化。作用机制:它被认为是通过抑制ATP柠檬酸裂解酶(ACL)发挥作用的,ACL是胆固醇合成途径的一部分,与他汀类药物抑制的酶上游几步。ESPR称ETC-1002只会延长他汀类药物的暴露时间,但不会增加最大浓度,ESPR没有透露更多的细节。
在Phase III - CLEAR Harmony试验中,ETC-1002对于HeFH或ASCVD患者,在第12周时LDL-C降低20%,第52周降低16%。在5-component MACE发生率为4%,安慰剂对照组为4.6%。ETC-1002联用依折麦布用于当前最大可耐受剂量的他汀药物仍无法控制LDL-C。
ETC-1002还进行了一项名为Phase III - CLEAR Harmony (1002-040),试验结果显示52周的MACE数据为:3-component MACE 1.9% vs placebo 2.3%,4-component MACE 3.8% vs placebo 4.2%, 5-component MACE 4.0% vs placebo 4.6%。该试验中还曾爆出ETC-1002也有较高的肝功能测试(LFT)升高率(0.54%),尽管该值在他汀类药物的标签范围内,但近半数的案例发生在试验的后半段,Informa处于谨慎的考虑,将该药的LOA下调了5%。
ESPR还开发了一款ETC-1002与依折麦布的合剂,二者联用时12周的LDL-C降低幅度可达35%,而ETC-1002在该试验中的数值为20%,依折麦布为24%。
ETC-1002当前已提交NDA,PDUFA为Feb. 21, 2020。获批的主要风险在于52周的CV数据和肝功能数据是否会受质疑。
若ETC-1002能获批,考虑到其口服给药的特性和降低LCL-C的能力,在定价合理的情况下,可能拿下一定的市场。
目前作用于PCSK9的在研药物还有一款单克隆抗体,两款疫苗,一款antisense药物,研发久未更新或多次延迟或仅处于I期,暂不考虑。
其它值得关注的药物包括:REGN的单抗药物Evinacumab,但目前仅用于HoFH,已进入III期;MDGL的MGL-3196,但当前适应症仅为HeFH,II期;RGNX的RGX-501,是一种腺病毒疗法,可表达LDL-R,能直接调节LDL-C的代谢,适应症为HoFH,目前处于I/II期,预计将于2019年发布cohort2的中期数据;AMGN和Arrowhead还开发了一款siRNA药物AMG 890,可降低脂蛋白酶的表达,处于临床I期,2020年中前发布I期Topline。考虑到其适应症和进度,暂不足以威胁到靶点为PCSK9的药物。
6
Inclisiran估值
Inclisiran的授权情况:2013年2月,Alnylam Pharmaceuticals(ALNY)和The Medicines Company(MDCO)达成合作协议,ALNY将旗下针对PCSK9的两款siRNA药物ALN-PCS02和ALN-PCSsc授权给MDCO,MDCO将负责药物II期及以后的临床开发工作和商业化,为此,MDCO付出2500万美元的先期付款,未来研发及商业化里程碑付款总金额为1.8亿美元,ALNY还享有20%的销售分成。
Inclisiran即ALN-PCSsc,ALN-PCS02的研发已暂停。
Inclisiran为化学修饰的siRNA,共价缀合GalNAc配体。ALNY已同意将Inclisiran的生产技术转移给MDCO或第三方合作生产商。
Inclisiran的价格:Inclisiran由MDCO或由第三方合作生产商生产,目前未知生产成本,但在规模化生产中,理论上能将成本降低。MDCO给出的评论是“Inclisiran的生产过程让其定价具有竞争力”。预计其价格低于或与Praluent和Repatha相当。BMT预估的药物销售模型中,Inclisiran的价格约为Praluent和Repatha的75%。
Inclisiran的巅峰销售额及巅峰销售时间:BMT预计Inclisiran将于2023年获得label expansion,将在2026年的销售额与Praluent和Repatha相当,约为56亿美元,因2026年是预测期的最后一年,不代表Inclisiran的巅峰销售额。
若进行保守地估计,假设Inclisiran于2025年获得Label Expansion。考虑到Praluent和Repatha已完成医保工作,Inclisiran的市场化进程应更快,较为保守地估计达到巅峰销售额的时间为2029年。根据上文,US、EU5和Japan未达到LDL-C控制目标的人数为2470万。该数据基于NHANES,约有76%的用药患者的LCL-C高于70mg/dl,高于心血管专家报告的30-40%。因此,进一步保守估计的话,患者总人数应为741万人。
接受PCSK9药物治疗的比例设为60%,Inclisiran、Praluent和Repatha三分市场。价格按照Praluent的75%计,及零售价约为4700美元,出厂价为3076(BMT假设)。则,保守的巅峰销售额为45.59亿美元。
综上,最保守地估计,Inclisiran的巅峰销售额于2029年取得,保守的巅峰销售额为45.59亿美元。
假设市销率为3。折现率设为10%。当前Inclisiran获批可能性为57%(10% Above Avg.)。则Inclisiran当前的保守价值为30.06亿美元。
MDCO拥有80%的权益,即MDCO拥有的Inclisiran价值24亿美元。
7
其它研发管线
MDCO公司历史悠久,最早于2000年以每股16美元的价格上市,目前旗下研发管线非常少,应已进行过资产剥离。
2018年1月,公司将旗下所有传染病资产剥离给了Melinta (MLNT),进一步聚焦于Inclisiran的研发。
目前,公司仅有Angiomax一款已获批药物,该药2000年获批,已过专利保护期,2018年销售额仅有610万美元,公司的10K文件提到已于2018年8月将Angiomax的权利出售给了Sandoz,2019年Q2生效。
此外,公司作为Partner参与阿斯利康(ANZ)的药物Brilinta在US的商业化,2018年Brilinta在美国的销售额为5.88亿美元,按照合作协议,阿斯利康每年将向MDCO支付1500万美元,用于开展预先商定的商业化活动。如果达到了业绩阈值,ANZ每年将额外支付至多500万美元。
(Angiomax的适应症为急性冠脉综合征和心绞痛,Brilinta当前获批的适应症为急性冠脉综合征,由此认为MDCO拥有较为丰富的心血管用药的商业化经验。)
8
公司现金状况
截至2019年3月31日,公司共有现金2.02亿美元,根据公司的预测,现金足够支持运营至2019年4月26日。
但是,公司仍在6月26日发布了增发公告,以33美元/股的价格增发,合计募资金额1.725亿美元(扣除费用前)。(考虑到公司自年初以来股价已近翻倍,推测公司管理层认为当前价位增发也不算亏。)
9
管理层
Mark Timney在2018年12月被任命为公司新的CEO,他曾在跨国药企中有超过25年的工作经历,在默克公司(Merck, MRK)有丰富的心血管产品发布经验。原CEOClive Meanwell, M.D., Ph.D.,将转任Chief Innovation Officer。
10
主要股东增减持情况
图7
11
公司近期股价异动
2019年6月24日盘后,MDCO宣布增发新股募资$150M(超额配售上限为$22.5M),募资所得用于Inclisiran的研发和一般用途。26日宣布增发价为33美元,超额配售681818股,交易在28日完成。公司股价在25日跌4.52%,随后几日一路回升,最高股价38.69美元。
2019年4月25日,公司发布Q1财报,Medicines盘前涨3%。股价当日微涨,次日大涨5.97%。
2018年12月12日盘后,公司宣布发行债券,次日股价大跌14.5%。2018年12月14日,公司USD150M的可转换债券定价,债券利率为3.5%,半年付一次利息,转换价格为普通股时按照25.19美元/股计(前一个交易日收盘价为19.76美元),股价小跌3.54%。
2018年12月11日,Mark Timney被任命为公司新的CEO,他曾在跨国药企中有超过25年的工作经历。原CEOClive Meanwell, M.D., Ph.D.,将转任Chief Innovation Officer. 股价当日无异动,次日大涨11.64%。
去年8月底-12月下旬,公司长期没有重大催化剂,股价自高位的~41美元,一路狂跌至最低16.69美元。(原因还有可能是因为Praluent和Repatha因当时过高的定价而销售不佳。)
2018年8月,首个siRNA药物Onpattro获批,这可能也是该公司股价在8月到达高位的原因之一。