Caco-2 细胞体外吸收模型的建立及验证
来源
医药导报2018 年11 月第37 卷第11 期
作者
吕晓君,曹易丹,何开勇
湖北省药品监督检验研究院
湖北中医药大学
摘要
目的:建立Caco-2 细胞体外吸收模型并对其进行验证,以利于药物吸收转运的研究。
方法:Caco-2 细胞接种于Transwell 24 孔微孔滤膜培养板上,培养3,6,9,12,15,18,21 d,通过观察细胞形态、绘制生长曲线、测定跨膜电阻值( TEER) ,比较低、中、高细胞浓度( 5×104,1×105,2×105·mL-1 ) 对细胞单层完整性的影响,以确定细胞接种密度和培养时间; 通过测定荧光黄的跨膜通透性、细胞膜顶侧( AP) 、基底侧( BL) 及细胞内的碱性磷酸酶活性验证细胞单层通透性和极性分化特征。
结果:低、中、高浓度细胞接种后分别在15,12,9 d 形成单层膜结构,吸光度达高峰,但生长后期高、中浓度组细胞出现成团、死亡,且TEER 值小于低浓度组。低浓度细胞接种15 d TEER 值达到300 Ω·cm2,15 ~ 21 d基本稳定; 选择低浓度( 5×104·mL-1 ) 为合适的浓度接种细胞,培养21 d 后,荧光黄的表观渗透系数( Papp) 为3.57×10-7cm·s-1,低于通透实验规定的5.0×10-7cm·s-1 ; 细胞内碱性磷酸酶活性增加,膜两侧碱性磷酸酶活性比值( AP /BL)增高5 倍多,细胞形成极性分化。
结论:所建立的Caco-2 细胞模型完整性、通透性与极性分化特征通过验证,可作为模拟小肠药物转运过程的体外模型。
关键词
Caco-2 细胞; 吸收,体外; 跨膜电阻值; 碱性磷酸酶; 渗透性
正文 |
人结肠腺癌细胞( the human colon adenocarcinomacell lines,Caco-2 细胞) 来源于人类结肠和直肠癌细胞,在体外培养过程中形成单细胞层后自发地进行上皮样分化,具有微绒毛结构以及细胞间紧密连接,分泌水解酶以及合成转运糖、氨基酸和药物等的载体转运系统[1]。
其形态学、标志酶的功能表达及渗透特征与小肠上皮细胞类似,将培养在微孔滤膜上的Caco-2 细胞构建的药物体外吸收过程与口服药物在肠道的吸收过程具有良好的相关性。
因此,Caco-2 单层细胞体外吸收模型可模拟小肠上皮细胞吸收转运的过程,广泛应用于新药开发、药物肠吸收机制的研究等[2]。
但由于细胞来源以及不同实验室培养条件的差异,特性会有所不同,各实验室对Caco-2 细胞模型的建立和验证标准存在差别,文献报道不一。
笔者在本实验通过对细胞形态学特征、生长活力、跨膜电阻值( transepithelialelectrical resistance,TEER) 、荧光黄表观渗透系数( apparent permeability coefficient,Papp) 和碱性磷酸酶活性等参数进行检测,评估和验证Caco-2 细胞模拟小肠吸收的体外模型系统,建立可靠、稳定、重复性好的Caco-2 细胞体外吸收模型,为本实验室后续的药物吸收、转运研究奠定实验基础。
1
材料与方法
1.1 制剂
Caco-2 细胞株,中国典型培养物保藏中心( 实验进行代数在20 ~ 50 代) ; DMEM 高糖培养基,Gibco 公司,批号: 907039; 胎牛血清,浙江天杭生物科技股份有限公司,批号: 20160712; 100×青链霉素混合液,Solarbio 公司,批号: 20161027; L-谷氨酰胺,天津市光复精细化工研究所,批号: 20090312; 胰酶,HyClone公司,批号: J150050; 汉克平衡盐溶液( Hank’sbalanced salt solution,HBSS ) ,Solarbio 公司,批号:20170203; 噻唑蓝( MTT ) ,Sigma 公司,批号:MKBP6775V; 二甲亚砜( DMSO) ,Sigma 公司,批号:RNBB4297; 荧光黄,北京化工厂,批号: Z00187; 碱性磷酸酶试剂盒,南京建成生物工程研究所,批号:20170317
1.2 仪器
XDS-1B 倒置光学显微镜( 重庆光电仪器总公司) ; VS-1300L-U 超净工作台( 苏州安泰空气技术有限公司) ; HF90 二氧化碳培养箱[力新仪器( 上海)有限公司]; TC20 细胞计数仪( 美国BIO-RAD 公司) ;Spark 10M 多功能酶标仪( 瑞士TECAN 公司) ; 3K15台式冷冻离心机( 德国Sigma 公司) ,Millicell ERS-2细胞电阻仪( 美国Millipore 公司) 。
24 孔悬挂式Transwell 培养皿( 美国Millipore 公司,孔径0.4 μm,有效膜面积0.33 cm2 ) ,25 cm2 培养瓶( 美国Corning 公司) ,24 孔、96 孔培养板( 美国Costar 公司) 。
1.3 Caco-2 细胞培养及形态学观察
Caco-2 细胞在25 cm2 培养瓶中用细胞培养液( 含10%胎牛血清、100 U·mL-1青霉素、100 U·mL-1 链霉素、2 mmol·L-1L-谷氨酰胺的DMEM 高糖培养液) 于37 ℃、5%CO2培养箱中培养。
每48 h 换液1 次,当细胞达到80%汇合时( 4~5 d) ,胰酶消化液消化,传代。当细胞均处于对数生长期时,于光镜下观察细胞形态并拍照。
在细胞生长状态良好时将细胞接种于24 孔Transwell 培养板上,滤膜顶侧( apical side,AP) 加入细胞悬液0.4 mL,基底侧( basolateral side,BL) 加入细胞培养液0.6 mL,见图1。
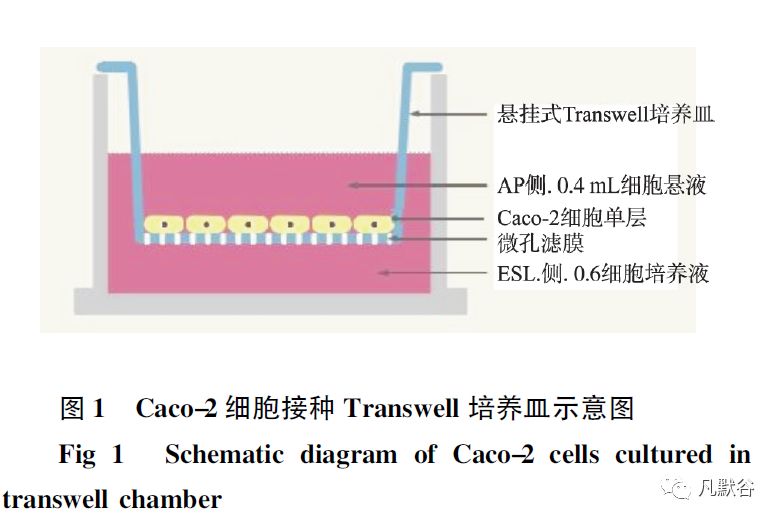
接种24 h 后更换培养液,此后每48 h 换液,7d 后每24 h 换液,细胞培养21 d 待用。
1.4 Caco-2 细胞生长曲线的绘制
按“1.3”项方法接种3 种不同浓度细胞于24 孔Transwell 培养板上,接种浓度分别为5×104·m L-1 ( 低浓度) 、1 × 105·m L-1( 中浓度) 、2×105·m L-1( 高浓度) ,每孔0.4 mL。
分别于接种后第3,6,9, 12, 15,18,21 天每个浓度分别取3孔细胞,吸弃培养液,用HBSS 洗涤2 次,弃去上清液后加入MTT 溶液( 5 mg·m L-1 ) 40 μL,无血清培养基360 μL, 37 ℃继续孵育4 h,终止培养,吸弃孔内培养液。
然后加入DMSO 400 μL,轻轻吹打混匀至紫色结晶物充分溶解,转移150 μL 至新96 孔板,在酶标仪波长490 nm 处测吸光度值( A 值) ,以时间为横坐标,A值为纵坐标绘制细胞生长曲线,观察3 种不同接种浓度细胞生长动态过程及其差别。
1.5 Caco-2 细胞单层完整性的确定
按“1.3”项方法接种3 种浓度细胞于24 孔Transwell 培养板上,接种浓度分别为5×104·m L-1( 低浓度) 、1×105·m L-1( 中浓度) 、2×105·m L-1( 高浓度) ,每孔0.4 mL。
分别于接种后第3,6,9, 12, 15,18,21 天每个浓度分别取3 孔细胞测定TEER 值,观察3 种不同接种浓度的细胞单层紧密连接的动态形成过程及其差别。
TEER 值=( R测定孔- R空白孔) × A,R测定孔为生长有Caco-2 细胞的Transwell 培养皿测得的电阻值,R空白孔为未接种细胞、仅加相同体积培养液的Transwell 培养皿的电阻值,A为有效膜面积( 0.33 cm2 ) 。
1.6 Caco-2 细胞单层通透性的验证
通过标志物渗漏检查实验评定Caco-2 细胞单层完整性的化合物有很多种,如苯酚红、甘露醇、荧光黄等,笔者在本实验采取荧光黄作为标志物来验证[3]。
1.6.1 荧光黄标准曲线绘制
用HBSS 分别配制0.005,0.01, 0.025, 0.05, 0.1 和0.25 μg·mL-1荧光黄标准溶液。
用酶标仪测定荧光强度( 激发波长427 nm,发射波长536 mn) 。以荧光强度为纵坐标,浓度( μg·mL-1 ) 为横坐标进行线性回归,绘制标准曲线。
1.6.2 荧光黄转运实验
根据“1.4”和“1.5”项实验结果选择一个合适的接种浓度,按“1.3”项所述方法接种Caco-2 细胞于24 孔Transwell 培养板上,细胞单层生长达21 d 后,取3 孔细胞吸弃培养液。
在AP 侧和BL侧均加预热的HBSS 清洗2 次,吸弃HBSS,在AP 侧加荧光黄( 20 μg·mL-1 ) 0.4 mL,BL 侧加HBSS 0.6 mL,在37 ℃,5 %CO2培养箱培养1 h,分别于30, 60 min 在BL 池取样100 μL,并补加相同体积的空白HBSS,在激发波长427 nm、发射波长536 mn 条件下,酶标仪检测荧光强度。
根据标准曲线与回归方程计算荧光黄在BL 侧转运液的浓度及Papp,以验证Caco-2 细胞单层的完整性。
Papp = ( dQ/dt) /( AC0) ,公式中: dQ/dt 为单位时间荧光黄转运量( μg·s-1 ) ,A 为有效膜面积( 0.33 cm2 ) ,C0为荧光黄的初始浓度( 20 μg·mL-1) 。
1.7 Caco-2 细胞生长分化特征的验证
碱性磷酸酶是Caco-2 细胞单层形成过程中分化出的刷状缘标志性酶,碱性磷酸酶活性可一定程度上标志细胞的分化程度。
本实验通过检测Caco-2 细胞膜两侧培养液及细胞内的碱性磷酸酶活性来观察细胞培养过程中的生化特性和细胞极性。
根据“1.4”和“1.5”项实验结果选择一个合适的接种浓度,按“1. 3”项所述方法接种Caco-2 细胞于24 孔Transwell 培养板上。
1.7.1 细胞膜两侧碱性磷酸酶活力的检测
分别于接种后第3,6,9,12,15,18,21 天,收集细胞膜AP 侧、BL 侧的培养液,按试剂盒说明书检测内、外侧细胞培养液中的碱性磷酸酶活力[金氏单位·( 100 mL)-1],计算内、外侧细胞培养液中的碱性磷酸酶活力比值( AP /BL) 。
1.7.2 细胞内碱性磷酸酶活力的检测
分别于接种后第3,6,9,12, 15,18,21 天,收集细胞,超声破膜后,BCA 法测定蛋白浓度,按试剂盒说明书检测碱性磷酸酶的活力[金氏单位·( g·pro) -1]。
2
结果
2.1 细胞生长形态观察
Caco-2 细胞在培养瓶中呈膜状贴壁生长,单个细胞形态为扁平状,呈多角形。当将细胞接种在微孔滤膜上经过一段时间的培养后,细胞会自发进行形态学上的分化,在表面形成良好的刷状缘,在细胞间形成紧密连接,成细胞单层。
本实验中,低浓度( 5×104·mL-1 ) 接种时,到第15 天融合成单层膜结构; 中浓度( 1×105·mL-1 ) 接种时,到第12天融合成单层膜结构; 高浓度( 2×105·mL-1 ) 接种时,到第9 天融合成单层膜结构。
细胞单层膜结构明显整体呈“铺路石样形态”,细胞之间紧密连接,见图2。
细胞融合后,数量达高峰,之后变化缓慢,高、中浓度接种时,在生长后期有团块细胞死亡。
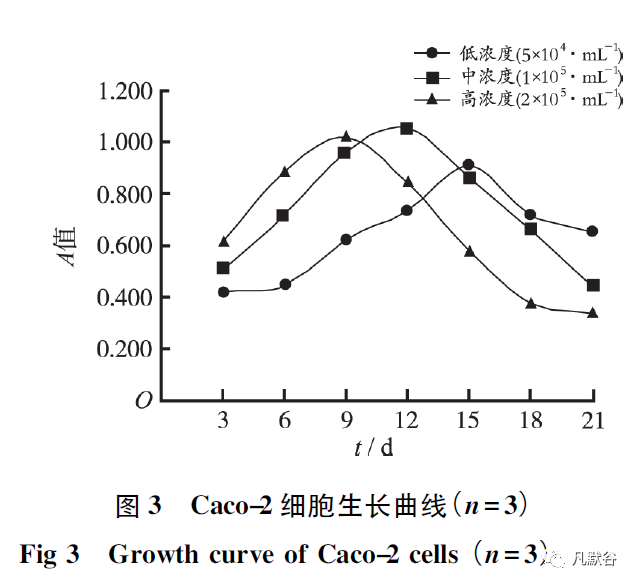
2.2 细胞生长曲线
由图3 可见,Caco-2 细胞接种后在早期生长迅速,A 值升高,在后期A 值逐渐降低,细胞生长曲线呈下降趋势。
但接种不同细胞浓度的Caco-2 细胞生长曲线有差别: 细胞在低浓度( 5 ×104·mL-1 ) 接种时第15 天生长达高峰,A 值为0.905;中浓度( 1×105·mL-1) 接种时第12 天生长达高峰,A值为1.055; 高浓度( 2×105·mL-1 ) 接种时在第9 天生长就可达高峰,A 值为1.021。
细胞在生长过程中,第3~9 天时,A 值与接种的细胞数量呈正相关,A高浓度>A中浓度>A低浓度; 在第15 ~ 21 天时,A 值与接种的细胞数量呈负相关,A高浓度<A中浓度<A低浓度,可能因为细胞数量太多时,培养液营养物质缺乏导致细胞死亡,从而引起A 值下降。
2.3 细胞单层完整性
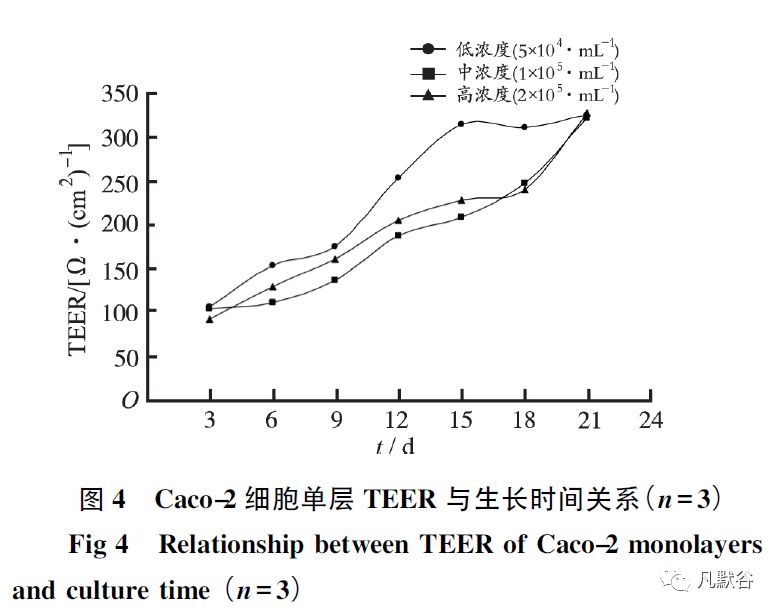
由图4 可见,Caco-2 细胞在生长过程中TEER 值呈逐渐增加趋势。
在接种后第3 天时各接种浓度的细胞TEER 值差别不大,在第6 ~ 18 天细胞TEER低浓度>TEER高浓度>TEER中浓度,在第21 天低、中、高浓度TEER 值基本一致,达到约300 Ω·cm2。
在细胞单层膜形成过程中,低浓度( 5×104·mL-1 ) 接种时TEER 值在3~9 d 时增长稍平缓,第9~15 天迅速增长,15 d 时TEER 值即可达到300 Ω·cm2,15 d 后基本稳定,保持不变至21 d,说明此时细胞膜单层完整性已形成; 而中、高浓度接种时TEER 值在3~18 d 时增长稍平缓,第18 ~ 21 天迅速增长,21 d 时TEER 值才达到300 Ω·cm2。
2.4 细胞单层通透性
结合“2.1”“2.2”“2.3”项细胞生长形态、生长曲线及TEER 值与时间关系的实验结果,Caco-2 细胞在低浓度接种时第15 天细胞生长达高峰且成团死亡细胞少, 15~21 d 细胞TEER 值可维持稳定,因此选择5×104·mL-1浓度接种细胞、培养21 d 进行荧光黄通透性试验和细胞极性研究。
荧光黄标准曲线绘制结果为: Y = 3658. 4X + 3. 9278,R2 为0.9993。将20 μg·mL-1荧光黄加入Caco-2 细胞后于30, 60 min 在BL 池取样,检测得荧光强度分别为( 135±32) ,( 350±74) ( n = 3) ,根据公式计算Papp 为3.57×10-7cm·s-1,小于通透性实验规定5.0×10-7 cm·s-1[4],可见Caco-2细胞在Transwell 板中培养21 d 后,已经形成了完整的单细胞层,可用于转运实验。
2.5 细胞生长分化特征
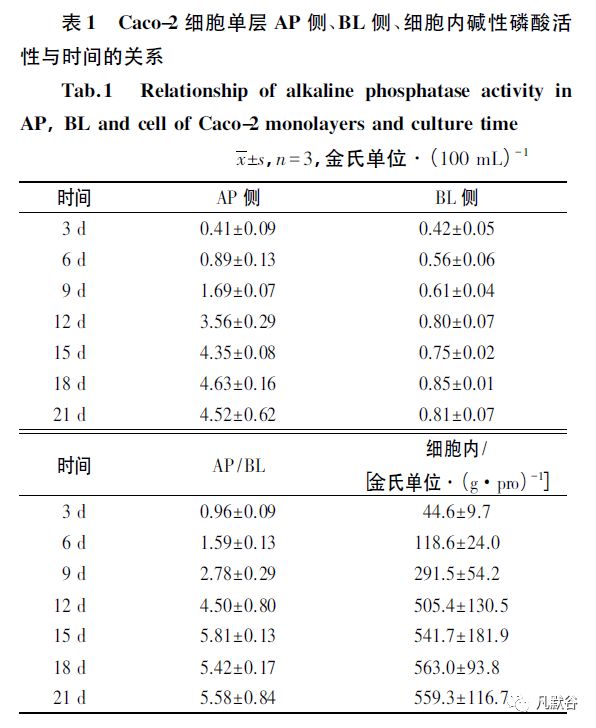
由表1 可见,在接种3 d 时Transwell 培养皿AP 侧和BL 侧的碱性磷酸酶活性基本一致,随着培养时间的延长,内、外两侧培养液中碱性磷酸酶活性均呈升高趋势,AP 侧与BL 侧的差异逐渐增大。
AP 侧在接种3 ~ 15 d 迅速增加、15 ~ 21 d 保持稳定,碱性磷酸酶活性增长幅度达10 倍; 而BL 侧在接种后的碱性磷酸酶活性增加平缓,到21 d 仅为3 d时2 倍。
计算两侧酶活性的比值,AP /BL 在第3 天时为( 0.96±0.09) ,6d 时明显增加, 15 d 时比值可增加至( 5.81±0.13) ,而后平稳维持在较高水平,说明AP侧碱性磷酸酶活性高于BL 侧,即产生了极化现象。
同时,细胞内的碱性磷酸酶活性在3 ~ 15 d 迅速增加、15~21 d 碱性磷酸酶活性变化趋于平稳,说明Caco-2细胞在生长过程中分化明显,具备药物转运需要的各种载体和酶。
3
讨论
Caco-2 细胞在体外培养时能进行形态和功能上的分化,在结构和功能上与小肠上皮细胞很相似,被认为是研究口服药物的前期筛选、营养素与毒素的吸收最好的细胞模型之一[5]。
Caco-2 细胞模型具有其自身的优势,但目前缺少细胞统一培养标准以及实验操作标准,特别是关于细胞接种的浓度和密度报道不一。
为评价本实验室所建立的Caco-2 单细胞层体外吸收模型,笔者采用显微镜观察结果和细胞生长曲线作为判断细胞生长状态的指标,采用TEER 值作为评价单细胞层完整性的指标,确定合适的细胞接种浓度。
本实验接种5×104·mL-1( 低浓度) 、1×105·mL-1( 中浓度) 、2×105·mL-1( 高浓度) 的细胞,观察了细胞生长过程中数量的增加、形态的变化及单层细胞TEER 值与时间的关系,结果显示: 细胞接种后,在早期生长迅速,A 值、TEER 值增加明显,之后趋于稳定,其中高浓度接种时A 值最早达到高峰,但在后期培养液中营养成分减少,代谢产物增多,细胞因营养的枯竭和代谢物的影响,发生密度抑制,导致细胞分裂停止、细胞成团、死细胞较多、A 值下降。
因此,细胞接种的密度要合适,本实验中5×104·mL-1接种细胞数量较为适宜,细胞接种15 d 能够较好地相互接触汇合成单层,且低浓度接种时的TEER 值较中、高浓度的TEER 值高,较早达到一个基本相对恒定的值( 300 Ω·cm2 ) 。
TEER 值由离子经细胞旁间隙的流动形成,因其操作简便、可重复测量而成为检测细胞单层完整性的常用指标[6]。
TEER 值与细胞连接的紧密程度有直接关系,随着培养时间延长,细胞紧密连接逐渐完善,TEER 值则相应地逐渐增大。
一般TEER 值在200 ~ 1000 Ω·cm2,值越大认为细胞单层越致密完整[7]。
本实验中低、中、高浓度细胞接种21 d 后TEER 值均可以达到300 Ω·cm2,说明Caco-2 细胞已形成了完整的单层细胞膜。
但结合细胞生长曲线和显微镜下细胞形态特征的观察,认为低浓度( 5×104·mL-1 ) 接种为比较合适的细胞密度,因此选择此浓度进行荧光黄转运实验、碱性磷酸酶活性测定实验对Caco-2 单细胞层的功能进行验证。
小分子标志物荧光黄的跨膜通透性是评价单细胞层完整性的指标,本实验以低浓度接种21 d 后,细胞间形成紧密连接,TEER 值达到恒定值,选择此时间点进行荧光黄转运实验,结果显示荧光黄Papp 为3. 57 ×10-7 cm·s-1,低于通透性实验规定的5. 0 ×10-7 cm·s-1,验证了细胞的紧密连接良好,形成了完整的细胞单层。
为了进一步评价Caco-2 细胞单层的极性分化程度,本实验检测了低浓度接种21 d 期间细胞膜两侧和细胞内碱性磷酸酶的活性的动态变化。
Caco-2细胞达到单层厚度后就开始自发进行上皮样分化, 21 d时肠腔侧形成一个界定明确的刷状边缘,细胞单层的微绒毛非常致密,长度均一,细胞间腔侧出现紧密连接而基底侧却无紧密连接[8]。
当细胞开始分化时,碱性磷酸酶是小肠上皮刷状缘细胞的标志性酶,作为衡量单细胞层的极化程度的指标[9-10]。
实验结果显示,Caco-2 细胞生长的21 d 期间,碱性磷酸酶活性升高,膜两侧碱性磷酸酶活性比值AP /BL 增高了5 倍多,可见碱性磷酸酶的分布非常不对称,出现了明显的极化现象。
对细胞内碱性磷酸酶活性的测定也验证了细胞在分化过程中,碱性磷酸酶活性渐渐增大,细胞慢慢产生了极性,可用于吸收和转运实验。
综上所述,Caco-2 细胞体外吸收模型与构建时间、细胞接种密度相关。本实验室通过显微镜观察细胞的形态、MTT 法测定细胞生长曲线、TEER 值测定细胞单层的完整性来对不同的细胞接种密度和培养时间进行比较,且通过测定荧光黄的跨膜通透性、碱性磷酸酶活性验证细胞的单层完整性和极性分化特征。
在本实验室条件下,以5 × 104 · mL-1 接种Caco-2 细胞于Transwell 24 孔微孔滤膜培养板上,AP 侧细胞悬液0.4 mL,BL 侧细胞培养液0.6 mL,培养21 d,细胞形态稳定,生长状态良好,TEER 值基本恒定,荧光黄透过量低,碱性磷酸酶细胞产生极性分化,细胞单层具有良好的完整性,可作为模拟小肠体外转运模型,研究药物的转运和吸收机制。