9月6日,首个国家亚健康干预技术成果利用中心落户长沙麓谷,国家中医药管理局亚健康干预技术实验室隶属于国家中医药管理局,是国内唯1从事亚健康干预技术研究的专业机构,具有以国家973项目主持人、教育部新世纪优秀人材为核心的研究团队,专业从事亚健康干预技术的研究。2012年9月,该实验室主任刘东波教授当选为联合国亚太亚健康干预技术同盟主席,以“未病防病、既病防变、愈后防复”为目标,对慢性非沾染性疾病提出心理、行动、膳食和营养干预方案,并于2016年成立了国家中医药管理局亚健康干预技术实验室糖尿病干预中心。糖尿病作为实验室创建后的1个重要的慢性病研究对象,历经长时间研究,独创了国内第1套糖尿病中医营养干预技术。
刘东波教授文献当中分享了国家中医药管理局亚健康干预技术实验室糖尿病干预中心研究成果。他指出,糖尿病中医营养干预技术就是以3低3高(低血糖负荷、低卡路里、低碳水化合物和高不饱和脂肪酸、高膳食纤维、高药食同源)的饮食模式和间歇性禁食方式医治糖尿病,以科学的方法为导向,重点教会糖尿病病人正确的健康生活方式,教会他们自我管理血糖的方法,逐渐实现恢复胰岛功能,重新夺回控制血糖的主动权,帮助广大糖尿病患者控制病情发展的问题,有益于糖尿病患者科学的自我管理,到达改良健康状态或医治疾病的目标。
以下是刘东波教授的文献:
稳定表达 RFP-GFP-LC3 的大鼠胰岛 β 细胞株的构建
周佳丽 1, 3 , 吴艳阳 2 , 罗玉霜 1, 3 , 袁玉菊 2 , 刘明俊 6 , 刘东波 1, 3, 4, 5*
1. 湖南农业大学 园艺园林学院, 中国湖南 长沙 410128;
2. 湖南农业大学 食品科学技术学院, 中国湖南 长沙 410128;
3. 国家中医药管理局亚健康干预技术实验室, 中国湖南 长沙 410128; 4. 湖南省作物种质创新与资源利用重点实验室,中国湖南 长沙 410128; 5. 湖南省植物功能成份利用协同创新中心, 中国湖南 长沙 410128; 6. 湖南省马王堆医院,中国湖南 长沙 410128
摘 要 : 为了简便自噬相干机理药物在胰岛 β 细胞上的高通量挑选 , 实验通过慢病毒转染技术 , 将 RFP-GFP-LC3质粒转入大鼠胰岛 β 细胞株 (RIN-m5f), 用 G418 对感染细胞进行挑选 , 激光共聚焦进行活细胞拍摄验证 , 得到100% 表达 RFP-GFP-LC3 质粒的细胞株。 无血清饥饿处理细胞 , 结果显示 : 饥饿组GFP/RFP 荧光点比值较对比组降落 , P62 蛋白表达量和 S6K 磷酸化水平下降 , 加入 10 μmol/L 氯喹部份抑制自噬后 , GFP/RFP 荧光点比值回升。 以上结果表明稳定表达 RFP-GFP-LC3 的 RIN-m5f 构建成功 , 并能够以简单的检测方式准确表达自噬全进程 , 为自噬在糖尿病药物机理方面的研究奠定了基础。
关键词 : 糖尿病 ; 自噬 ; 慢病毒转染 ; RIN-m5f 细胞株
中图分类号 : Q291 文献标识码: A 文章编号 : 1007⑺847(2019)02-0087-05
糖尿病是1种全球性的、以延续高血糖症为特点的代谢紊乱疾病。血糖异常升高的缘由多是胰岛素本身分泌缺点(1 型糖尿病, T1D), 或肝脏等效应器官产生胰岛素抵抗, 或胰岛素分泌不足(2 型糖尿病, T2D)
[1] 。在 T1D 和 T2D 的情况下, 延续高浓度的葡萄糖会引发细胞内抗氧化能力的失衡, 致使亚硝基介导的氧化应激和损伤。氧化和糖化蛋白的积累是糖尿病相干的常见蛋白质修饰, 其部份缘由多是自噬缺点
[2] 。因此, 愈来愈多的研究认为相干细胞自噬可能有益于糖尿病的医治。β 细胞是人体内唯1能够分泌胰岛素的功能细胞, 研究 β 细胞的自噬对糖尿病的医治与控制具有重大意义。相干研究报导, β 细胞自噬可通过调控胰岛素颗粒的降解来影响细胞胰岛素的释放 [3~4] 。自噬是真核细胞内1种高度守旧的再循环进程, 它通过降解细胞质中的细胞器、蛋白质和大份子物资, 对分解产物进行再利用。自噬在细胞存活和功能保持中起侧重要作用 [5] 。细胞自噬由多个步骤组成, 其中包括:
1) 吞噬泡的构成;
2) 自噬体的构成;
3) 自噬体与溶酶体融会构成自噬溶酶体;
4) 自噬溶酶体的降解 [6] 。自噬流是这些步骤在细胞内连续出现的动态进程, 自噬流的活化或受阻常常会构成不同的生物学效应 [7] 。人们在研究进程中逐步发现, 自噬流受阻可能引发多种疾病 [7] 。微管相干蛋白轻链 3 (microtubule-associatedprotein light chain 3, LC3)是自噬体膜标志物, 1般散在散布于细胞质 [8] 。在自噬进程中, 胞质情势的LC3 (LC3-Ⅰ)与磷脂酰乙醇胺结合构成 LC3-磷脂酰乙醇胺结合物(LC3-Ⅱ) [9] 。
红色荧光点-绿色荧光点-LC3 (red fluorescence point-green fluores-cence point-LC3, RFP-GFP-LC3)融会蛋白是1种方便的自噬荧光蛋白标记物。在自噬产生早期,
胞浆型 LC3 转变成膜型 LC3, 在荧光显微镜下可视察到红色/绿色共定位的点状聚集。自噬后期,溶酶体与自噬体融会构成自噬溶酶体, 细胞环境pH 产生变化。当环境 pH<5 时, GFP 荧光敏感产生淬灭, 只能检测到红色荧光点状聚集 [10] 。因此可以通过 GFP 荧光点与 RFP 荧光点比例来评价自噬流进程。目前可通过瞬时转染的方法检测自噬流, 通过在细胞中瞬时高表达 RFP-GFP-LC3 质粒来进
行后续实验 [11] , 但是瞬时转染的方法具有稳定性差、转染效力低等缺点。为解决这1问题, 我们通过慢病毒转染的方法构建了能够稳定表达 RFP-GFP-LC3 质粒的大鼠胰岛 β 细胞株, 这将有益于研究自噬在胰岛 β 细胞中的作用, 同时也可将其用于医治糖尿病药物的初步挑选。
1 材料与方法
1.1 材料
慢病毒包装系统(该病毒系统包括 VSVG 质粒、Δ8.9 质粒); 293FT 细胞、RIN-m5f 细胞株(湖南农业大学亚健康实验室冻存); DH5α 感受态细胞(北京全式金生物技术有限公司)。DMEM 培养基、1640 培养基、胎牛血清(fetal bovine serum, FBS)(Biological Industries 公司, 以色列); Trypsin-ED-TA 细胞消化液(北京全式金生物技术有限公司);Lipofectamine TM 3000 转染试剂(Thermo 公司, 美国);
G418 试剂(Sigma 公司, 美国); 防荧光淬灭封片剂(SouthernBiotech 公司, 美国); SQSTM1/P62 (seques-tosome 1)抗体、S6K (ribosomal protein S6 kinase)抗体、phospho-S6K 抗体(CST 公司, 美国); GAPDH(glyceraldehyde⑶-phosphate dehydrogenase)抗体[亚太恒信生物科技(北京)有限公司]; 6× loading
buffer (北京全式金生物技术有限公司)。激光共聚焦显微镜(Zeiss LSM710); 颠倒荧光显微镜(LeicaDMI8)。
1.2 慢病毒载体构建
慢病毒载体构建由上海吉凯基因科技有限公司完成, 构建进程主要参照文献[12]的方法, 扼要概述以下: 用 PCR 从 PCMV-RFP-GFP-LC3 质粒中扩增 RFP-GFP-LC3 片断; 扩增产物 10 g/L 琼脂转化, 挑选出重组质粒, 得到 RFP-GFP-LC3-GV374 质粒。经过测序比对确认慢病毒载体构建成功(图1), 提取重组质粒, 纯化溶解, ⑵0 ℃保存。
1.3 慢病毒的包装制备
用含有 10% FBS 的 DMEM 基础培养基于37 ℃、5% CO 2 培养箱中培养 293FT 细胞, 细胞状态良好。待细胞会合至 90%左右, 将其用含0.25%of autophagy related to diabetic medicines.Key words: diabetes; autophagy; lentivirus transfection; RIN-m5f cells(Life Science Research,2019,23(2):087~091)88第 2 期 周佳丽等:稳定表达 RFP-GFP-LC3 的大鼠胰岛 β 细胞株的构建。
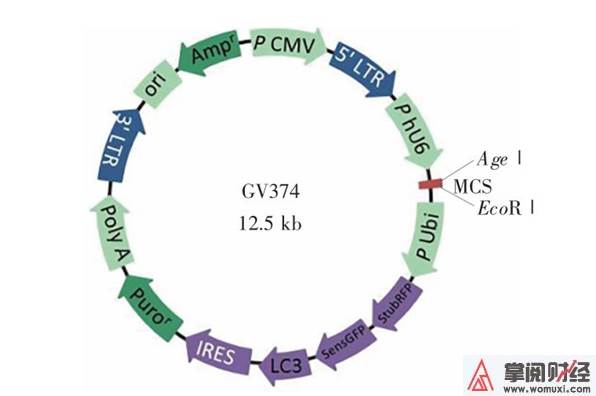
图 1 LC3 自噬流检测慢病毒载体图谱
Fig.1 The vector of lentivirus for detecting LC3
EDTA 的胰酶消化, 种入 6 孔板中, 培养 24 h。待细胞会合度达 50%左右时, 进行换液处理并依照转染试剂 Lipofectamine TM 3000 的说明书进行操作。行将 VSVG 质粒、Δ8.9 质粒、RFP-GFP-LC3质粒进行质量浓度 1︰1︰1 的共转染, 转染完成后将细胞置于 37 ℃、5% CO 2 培养箱中继续培养24 h。到达时间后, 于颠倒荧光显微镜下视察转染效力, 并搜集细胞上清液, 3 000 r/min 离心 10 min,去除残余的 293FT 细胞杂质, 即得到已包装好RFP-GFP-LC3 质粒的慢病毒颗粒。
1.4 稳定细胞株的挑选
转染前1天, 将 RIN-m5f 用 0.25% EDTA 胰酶进行消化, 种入 6 孔板中。用含 10% FBS 的1640 培养基培养 24 h 后, 将搜集的慢病毒颗粒加入细胞培养液中, 对细胞进行换液处理。24 h后, 在颠倒荧光显微镜下视察转染情况, 并更换新的培养基。感染约 48 h 后, 加入嘌呤霉素进行挑选培养。预实验提示 RIN-m5f 细胞的嘌呤霉素最好挑选质量浓度为 6 μg/mL。挑选培养约 7 d后, 未经感染的对比组细胞全部死亡, 感染组有阳性克隆细胞生长, 荧光显微镜下可见 RFP 荧光
与 GFP 荧光。用 0.25% EDTA 胰蛋白酶消化阳性克隆细胞, 转移到新的培养皿中继续培养 2 d, 随后搜集感染病毒的稳定细胞株, 用细胞免疫荧光的方法检测 RFP-GFP-LC3 的表达。
1.5 自噬的引诱及自噬流的检测
构建成功的细胞以 1×10 5 的数目种入 24 孔板中, 37 ℃、5% CO 2 条件下培养过夜。待细胞会合至 70%左右, 对比组使用含 10% FBS 的 1640培养基继续培养, 饥饿组加入无血清 1640 培养基饥饿 2 h, 在饥饿+氯喹(chloroquine, CQ)组, 使用 10 μmol/L 的氯喹与饥饿共处理 2 h。到达预定处理时间后, 用 PBS 清洗两遍, 将玻片夹出反向固定于载玻片上, 于激光共聚焦下拍摄 RFP-GFP-LC3 荧光点。
1.6 Western-blot 分析
构建成功的细胞以 1×10 5 的数目种入 24 孔板中, 37 ℃、5% CO 2 条件下培养过夜。待细胞会合至 95%左右, 加入无血清 1640 培养基饥饿处理 2 h, 在饥饿+CQ 组, 使用 10 μmol/L 的氯喹与饥饿共处理 2 h。到达预定时间后, 用 PBS 洗涤细胞, 每孔加入 200 μL 2% SDS 细胞裂解液, 迅速将细胞刮下搜集。每管加入 40 μL 的 6× loadingbuffer, 煮至蛋白质变性, 蛋白质可置于⑵0 ℃冰箱保存备用。12% SDS-PAGE 电泳后, 电转移至PVDF 膜上, 封闭液室温封闭 1 h, 依照 1︰1 000的稀释比例, 分别孵育 P62、S6K、P-S6K、GAPDH1抗, 4 ℃过夜, 加入对应2抗稀释液(1︰5 000),室温孵育 1 h, ECL 发光显影。
1.7 统计学处理
所有数据用平均值±标准差(x±s)表示。多组间比较采取单因素方差分析; 显著性水平为 P<0.05。
2 结果
2.1 稳定细胞系的挑选
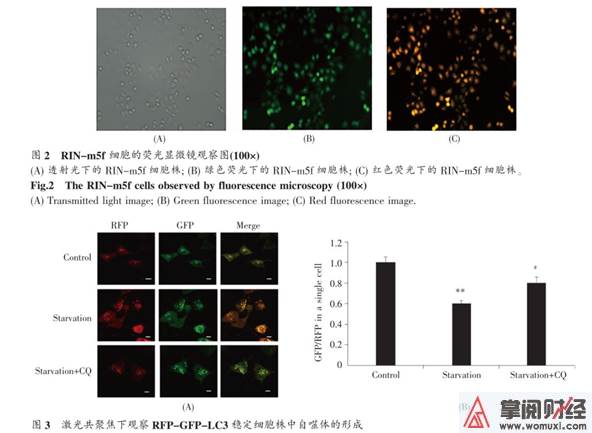
慢病毒转染 48 h 后, 用嘌呤霉素对已转染细胞株进行挑选。大约 7 d 后, 经过挑选的细胞如图2所示, 在荧光显微镜下视察到 100% 表达红色/绿色荧光, 表明稳定表达 RFP-GFP-LC3 的大鼠胰岛细胞已建立成功。
2.2 自噬的引诱和自噬流的检测
如图 3A 所示, 在本实验中可明显视察到对比组中自噬体较少且红色荧光与绿色荧光的表达量1致。经过饥饿自噬引诱以后, 自噬点显著增加, 细胞中绿色荧光点的表达量显著低于红色荧光的表达量。该现象是由于饥饿引诱构成了自噬流, 自噬体与溶酶体结合构成自噬溶酶体, 在自噬溶酶体的酸性环境下, 绿色荧光点产生淬灭。在对细胞进行饥饿处理的同时加入 10 μmol/L 的CQ, 发现绿色荧光的表达量较饥饿组略有回升。这是由于自噬阻断剂 CQ 部份阻断了自噬体与溶酶体的结合, 从而致使绿色荧光表达量的上升。单个细胞中红绿荧光点的比值在各组间具有统计学差异(图 3B)。
图 3 激光共聚焦下视察 RFP-GFP-LC3 稳定细胞株中自噬体的构成
(A) 2 h 血清饥饿后 , RFP-GFP-LC3 稳定细胞株中自噬体的构成图 ( 标尺 50 μm); (B) 图 A 中绿色荧光点 / 红色荧光点的统计结果。 **: P<0.01, 与对比组相比 ; #: P<0.05,与饥饿组相比。
Fig.3 Observation of autophagy formation in RFP-GFP-LC3 stable cell line under laser scanning microscopy(A) The formation of autophagosomes in RFP-GFP-LC3 stable cell line after serum starvation for 2 h (scale bar 50 μm); (B)The cells were treated as described in (A) and the statistical results of green/red fluorescence points were analysed by SPSS 10.0software. **: P<0.01 vs. control group; #: P<0.05 vs. starvation group.
图 2 RIN-m5f 细胞的荧光显微镜视察图(100×)
(A) 透射光下的 RIN-m5f 细胞株 ; (B) 绿色荧光下的 RIN-m5f 细胞株 ; (C) 红色荧光下的 RIN-m5f 细胞株。
Fig.2 The RIN-m5f cells observed by fluorescence microscopy (100×)
(A) Transmitted light image; (B) Green fluorescence image; (C) Red fluorescence image.
2.3 自噬引诱后相干蛋白质的表达分析细胞经过无血清饥饿处理 2 h 后用 2% SDS溶液裂解, 搜集总蛋白质, 采取 Western-blot 的方法检测自噬相干蛋白质 P62 及 S6K 的表达水平。结果如图 4 所示, 自噬底物 P62 蛋白的水平降落,与此同时 m-TOR 活性评价蛋白质 S6K 的磷酸化水平降落, 由此证明自噬流被成功引诱, 与图 3结果所示1致。
3 讨论
最近几年来, 愈来愈多的证据表明, 自噬是1种医治糖尿病的新靶点, 具有多种有益作用。同时许多药物和天然产物通过量种信号途径参与自噬调理, 包括引诱或抑制自噬 [13] 。有实验研究表明传统中药消渴平可通过引诱自噬抑制小鼠胰岛细胞
在高糖培养下的细胞凋亡 [14] , 这对糖尿病的研究具有重大意义, 同时也提示自噬的精准检测愈发重要。目前, 通过细胞免疫荧光技术和 West-ern-blot 对 LC3-Ⅰ和 LC3-Ⅱ的检测, 其实不能完全地反应自噬的整体进程。本实验通过慢病毒转染的方法, 将已融会的红色荧光蛋白、绿色荧光蛋白与 LC3 蛋白转入 RIN-m5f 细胞, 这样能够在较为简单的共聚焦活细胞拍摄下, 清楚视察到细胞自噬的全部进程, 实验简便易行。
双荧光 RFP-GFP-LC3 体系是比 GFP-LC3更全面可靠的自噬定量分析方法。该体系最大的优点是不需要外加其他药物干预, 可以同时直观地判断细胞自噬活性和自噬流(自噬通量)的变化 [15~16] 。在本研究中, 我们应用慢病毒转染的方法, 成功构建了表达 RFP-GFP-LC3 的大鼠胰岛 β 细胞株,并通过 G418 进行挑选, 应用激光共聚焦拍摄手段进行检测, 发现细胞终究能 100%表达 RFP-GFP-LC3 质粒。在此基础上, 根据 RFP 与 GFP 对pH 的不同适应度 [17~18] , 通过无血清饥饿引诱细胞自噬, 结果显示: 在饥饿条件下, 绿色荧光点因溶酶体环境 pH 较低产生淬灭, 而红色荧光点稳定存在, 因此 GFP/RFP 荧光点的比值降落; 当加入
10 μmol/L 氯喹部份阻断自噬流后, LC3 没法与溶酶体融会, 绿色荧光点数回升。这1实验现象符合饥饿引诱的自噬情况 [19] 。自噬是1个动态的进程,该双色荧光体系能够准确地同时显示和辨别自噬体和自噬溶酶体, 是检测自噬流的最好方法 [20] 。目前, 双荧光 RFP-GFP-LC3 已逐步得到许多学者的认可, 在自噬相干研究中发挥了重要作用 [21~23] 。本实验中, 稳定表达 RFP-GFP-LC3 质粒的大鼠胰岛细胞株的成功构建不但解决了传统自噬检测手段—— — 细胞免疫荧光技术需要相应1抗/2抗的孵育、实验本钱较大、步骤繁琐耗时的缺点 [24] ,而且为自噬在糖尿病的相干研究提供了细胞平台, 有益于自噬相干机理药物在胰岛 β 细胞上的高通量挑选, 为糖尿病药物的开发提供了便利。参考文献(References):[1] WANG P, FIASCHI-TAESCH N M, VASAVADA R C, et al. Di-abetes mellitus-advances and challenges in human β-cell prolif-eration[J]. Nature Reviews Endocrinology, 2015, 11(4): 201⑵12.[2] PRIYADARSHINI M, WICKSTEED B, SCHILTZ G E, et al. SC-FA receptors in pancreatic beta cells: novel diabetes targets?[J].Trends in Endocrinology & Metabolism, 2016, 27(9): 653⑹64.[3] YAMAMOTO S, KURAMOTO K, WANG N, et al. Autophagydifferentially regulates insulin production and insulin sensitivi-
ty[J]. Cell Reports, 2018, 23(11): 3286⑶299.[4] GOGINASHVILI A, ZHANG Z, ERBS E, et al. Insulin gran-ules. Insulin secretory granules control autophagy in pancreat-ic β cells[J]. Science, 2015, 347(6224): 878⑻82.
[5] PARZYCH K R, KLIONSKY D J. An overview of autophagy:morphology, mechanism, and regulation[J]. Antioxidants and Re-dox Signaling, 2013, 20(3): 460⑷73.[6] MEIJER A J, CODOGNO P. Autophagy: a sweet process in di-abetes[J]. Cell Metabolism, 2008, 8(4): 275⑵76.[7] 秦正红, 乐卫东. 自噬: 生物学与疾病[M]. 北京: 科学出版社(QIN Zheng-hong, LE Wei-dong. Autophagy: Biology and Dis-ease[M]. Beijing: Science Press), 2011: 415⑷20.[8] NAKATOGAWA H, ICHIMURA Y, OHSUMI Y. Atg8, a ubiq-
uitin-like protein required for autophagosome formation, me-diates membrane tethering and hemifusion[J]. Cell, 2007, 130(1):165⑴78.
[9] KABEYA Y, MIZUSHIMAN, UENOT, et al. LC3, a mammalian
homologue of yeast Apg8p, is localized in autophagosome mem-
branes after processing[J]. The EMBO Journal, 2000, 19(21):5720⑸728.
[10] KHARAZIHA P, CHIOUREAS D, BALTATZIS G, et al. So-rafenib-induced defective autophagy promotes cell death bynecroptosis[J]. Oncotarget, 2015, 6(35): 37066⑶7082.[11] FAN H D, CHEN S P, SUN Y X, et al. Seipin mutation at gly-cosylation sites activates autophagy in transfected cells via ab-normal large lipid droplets generation[J]. Acta Pharmacologica
Sinica, 2015, 36(4): 497⑸06.[12] HU D, WU J, ZHANG R, et al. Autophagy-targeted vaccine ofLC3-LpqH DNA and its protective immunity in a murine modelof tuberculosis[J]. Vaccine, 2014, 32(20): 2308⑵314.[13] ZHANG X W, ZHOU J C, HU Z W. Autophagy as a target fordevelopment of anti-diabetes drugs derived from natural compounds[J]. Journal of Asian Natural Products Research, 2017, 19(4): 314⑶19.[14] WU Y, HU Y, ZHOU H, et al. Xiaokeping-induced autophagyprotects pancreatic β-cells against apoptosis under high glucosestress[J]. Biomedicine & Pharmacotherapy, 2018, 105: 407⑷12.[15] KIMURA S, NODA T, YOSHIMORI T. Dissection of the au-tophagosome maturation process by a novel reporter protein,tandem fluorescent-tagged LC3[J]. Autophagy, 2007, 3(5): 452⑷60.[16] SHANWARE N P, BRAY K, ENG C H, et al. Glutamine de-privation stimulates mTOR-JNK-dependent chemokine secre-tion[J]. Nature Communications, 2014, 5: 4900.[17] MAUVEZIN C, AYALA C, BRADEN C R, et al. Assays to mon-itor autophagy in Drosophila[J]. Methods, 2014, 68(1): 134⑴39.[18] SINGH, OJHA S, BHATTACHARYA A, et al. Stable transfectionand continuous expression of heterologous genes in Entamoebainvadens[J]. Molecular and Biochemical Parasitology, 2012, 184(1): 9⑴2.[19] DEVENISH R J, PRESCOTT M. Autophagy: starvation relievestranscriptional repression of ATG genes[J]. Current Biology, 2015,25(6): R238-R240.[20] NODA N, FUYUHIKO I. Mechanisms of autophagy[J]. AnnualReview of Biophysics, 2015, 44(1): 101⑴22.[21] XU L, SHEN J, YU L, et al. Role of autophagy in sevoflurane-
induced neurotoxicity in neonatal rat hippocampal cells[J]. BrainResearch Bulletin, 2018, 140: 291⑵98.[22] BOLTON M G, COLIVEN O M, HILTON J. Specificity of isozymesof murine hepatic glutathione S-transferase for the conjugationof glutathione with L-phenylalanine mustard[J]. Cancer Re-
search, 1991, 51(9): 2410⑵415.[23] GINET V, SPIEHKMANN A, RUMMEL C, et al. Involvement ofautophagy in hypoxic-excitotoxic neuronal death[J]. Autophagy,2014, 10(5): 846⑻60.[24] CLAESSENS J, BELMONDO T, LANGHE E D, et al. Solid phaseassays versus automated indirect immunofluorescence for detection of ant inuclear antibodies[J]. Autoimmunity Reviews, 2018,17(6): 533⑸40.