北京时间2019年10月7日17:30,诺贝尔奖委员会公布了2019年生理学或医学奖获得者名单,美国科学家William G. Kaelin, Jr.、英国科学家Sir Peter J. Ratcliffe和美国科学家Gregg L. Semenza因发现细胞如何感应和适应氧气供应而摘得诺奖。
动物需要氧气才能将食物转化为有用的能量,氧气的重要性也早已世人所知,但长期以来人们一直不清楚细胞如何适应氧气水平的变化。
William G. Kaelin, Jr.,Sir Peter J. Ratcliffe和Gregg L. Semenza等学者的工作开创性地揭示了生命中最重要的过程之一,为我们了解氧水平如何影响细胞代谢和生理功能奠定了基础。

氧气:中心作用
——发现并分离氧气
1770年代初期,瑞典科学家Carl Scheele通过计算得出,空气中大约有四分之一的成分为“火气”(大气中允许物质燃烧的成分)。
在同一时间,英国科学家Joseph Priestley还找到了一种净化这种气体的方法。Antoine Lavoisier与Scheele和Priestley同时在巴黎分离了该物质,并且Lavoisier给该气体赋予了我们今天所熟知的名字:氧气。
——对氧化反应研究的逐渐深入
现已证明,氧气(O2)约占地球大气层的五分之一。氧气对于生命至关重要,几乎所有动物细胞中的线粒体都会利用氧气,氧化反应促使食物中的营养成分转化为ATP。
• 1858年,Louis Pasteur第一个证明动物细胞中氧气的利用存在复杂平衡,并且细胞使用多种途径来完成能量转换;
• 1931年诺贝尔生理学或医学奖获得者Otto Warburg曾阐述这种转换是酶促过程;
• 1938年诺贝尔生理学或医学奖获得者Corneille Heymans发现,通过颈动脉进行血氧传感可以与大脑直接通信来控制呼吸频率。
然而,在整个20世纪,尚不清楚如何细胞是如何在基因水平上调节对氧通量的适应。
适应氧气变化者方能适应环境
在几乎所有动物细胞中,快速响应并适应氧气变化的能力是至关重要的。
在进化过程中,随着动物细胞开始形成多细胞三维结构,细胞需要以多种自主方式适应氧水平的变化。例如,在高海拔地区生活的人类,肾脏中的特殊细胞会感应到血液中氧气水平的变化,这些特殊细胞会产生并释放促红细胞生成素(EPO),以激活骨髓中的红细胞的生成。
动物细胞感知不同浓度氧气的能力以及重塑基因表达模式的能力对于几乎所有动物的生存都是必不可少的。
从1970年代和1980年代的研究中可以明显看出,氧分压这些局部和瞬时变化能够引起基因转录的变化,而氧激活信号传导途径至少会影响300个基因,属于多模式调控网络。
HIF:重要媒介
EPO控制红细胞生成的重要性早在20世纪初就已为人所知,但这种过程是如何通过氧气本身控制则仍然是个谜。
Gregg Semenza研究了EPO基因以及如何通过改变氧气含量来调节它。通过使用基因修饰的小鼠证明,位于EPO基因旁边的特定DNA片段介导了对缺氧的反应。Sir Peter J. Ratcliffe还研究了EPO基因的氧气依赖性调节,两个研究小组都发现,氧传感机制不仅存在于通常产生EPO的肾细胞中,几乎所有组织细胞中都存在这种机制 [1]。
Gregg Semenza在培养的肝细胞发现了一种蛋白质复合物,该复合物以一种氧依赖性的方式与已鉴定的DNA片段结合,他称这种复合物为缺氧诱导因子(HIF)。
1995年,Gregg Semenza鉴定了编码HIF的基因,发现HIF由两种不同的DNA结合蛋白组成,即转录因子HIF-1a和ARNT [2]。
VHL:意想不到的合作伙伴
William Kaelin,Jr.几乎与Semenza和Ratcliffe等同时探索EPO基因的调控,William Kaelin,Jr.那时正在研究一种遗传综合征,即von Hippel-Lindau病(VHL病)。
这种遗传疾病会导致遗传性VHL突变的家庭罹患某些癌症的风险急剧增加。Kaelin表明,VHL基因编码一种可预防癌症发作的蛋白质,而缺乏功能性VHL基因的癌细胞会异常高水平地表达低氧调节基因,这一现象表明VHL以某种方式参与了对缺氧反应的调控。
Ratcliffe及其研究小组随后做出了一个关键发现,证明VHL可以与HIF-1a发生物理相互作用,因而VHL是复合物的一部分,通过泛素化标记在蛋白酶体中降解(图1)[3-5]。
图1. 当氧水平较低时,HIF-1a被保护免于降解并积聚在细胞核中,与ARNT结合并与低氧调节基因中的特定DNA序列(HRE)结合(1);在正常的氧气水平下,HIF-1a被蛋白酶体迅速降解(2);氧气通过向HIF-1a添加羟基(-OH)来调节降解过程(3);VHL蛋白可以识别并与HIF-1a形成复合物,从而导致其以氧依赖性方式降解(4)
氧气影响生理和病理
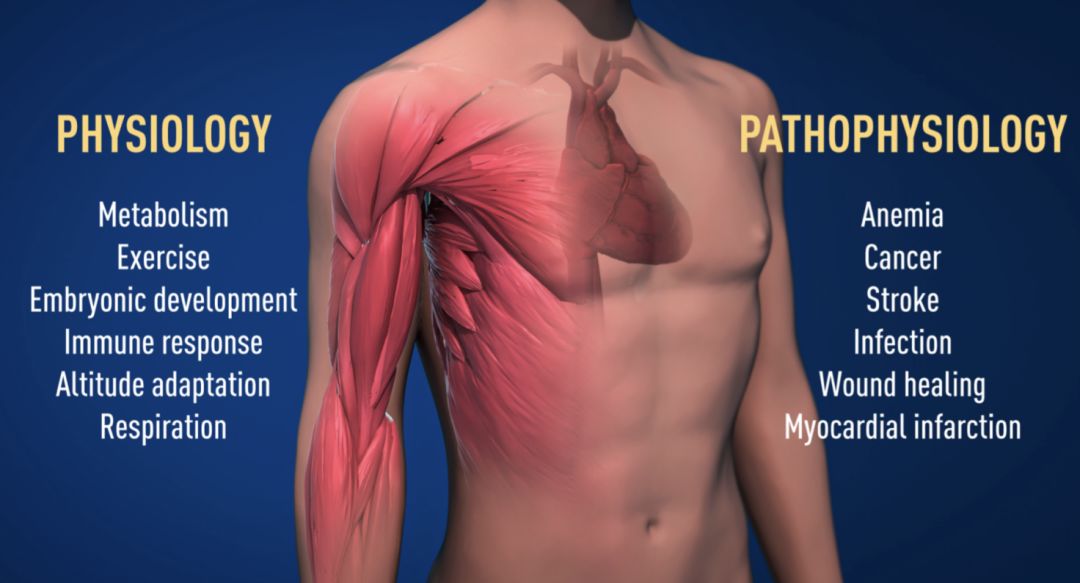
由于这些诺贝尔奖获得者的开创性工作,我们对氧气水平的调节有更多了解。同时,氧感应也是许多疾病的核心(图2)。
• 例如,患有慢性肾功能衰竭的患者通常由于EPO表达降低而患有严重贫血,EPO由肾脏细胞产生,对于控制红细胞的形成至关重要。
• 此外,氧调节机制在癌症中也具有重要作用。肿瘤细胞利用氧气调节机制刺激血管形成并重塑新陈代谢,从而使癌细胞有效增殖。在学术实验室和制药公司中,正在努力开发能够激活或阻断氧气感应机制的药物。
图2. 氧传感机制在新陈代谢、免疫反应和运动方面具有重要作用
HIF控制途径的广泛意义
许多小组的工作表明了HIF途径的稳定性在生理和病理中具有重要作用。
从药理学角度讲,HIF功能增强可能有助于治疗多种疾病,因为HIF已被证明对于免疫功能、软骨形成和伤口愈合等多种生理现象是至关重要的。
相反,抑制HIF功能也可能有许多应用:在许多癌症以及某些心血管疾病(包括中风、心脏病发作和肺动脉高压)中,HIF的水平都会升高。
在目前实践中,调节HIF-1a稳定性的脯氨酸羟化酶(PHD酶)的发现使得寻找羟化酶抑制剂来增加HIF的水平成为可能,这为药物的研发开辟了新途径。
实际上,许多通过抑制PHD酶来提高HIF功能的潜在药物在临床试验中已经走得很远,最近的一系列研究证明了它们在治疗贫血方面的临床功效。
与此同时,EPAS1阻滞剂被认为能够治疗某些由VHL突变诱导的癌症,Kaelin及其同事证明,EPAS1阻滞剂能够减慢动物模型中VHL突变细胞的增殖。
结语
今年诺贝尔奖获得者的开创性工作揭示了生命中最重要的适应过程之一,他们为我们了解氧水平如何影响细胞代谢和生理功能奠定了基础,也为抗击贫血、癌症和许多其他疾病的新策略铺平了道路。
[1]Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
[2]Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
[3]Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
[4]Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
[5]Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2- regulated prolyl hydroxylation. Science, 292, 468-472.
- End ▎生物谷 Bioon.com -