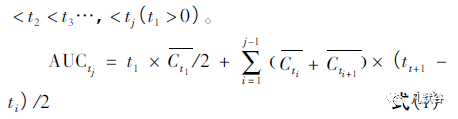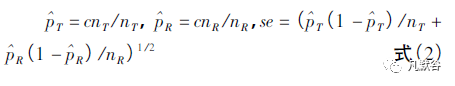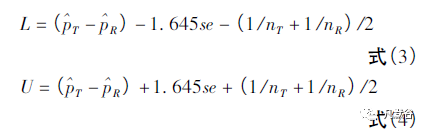中国食品药品检定研究院
摘要
制剂生物等效性试验是评价仿制药内在质量的关键之一。
FDA 颁布的《特定品种生物等效性指导原则》中,对眼用制剂如何进行生物等效性试验提出相应要求,其要点包括试验设计、生物等效性研究对象的选择、检测指标、生物豁免原则等,以上指南对我国正在开展的仿制药质量与疗效一致性评价工作有着重要的借鉴意义。
关键词
生物等效性试验; 指导原则; 参比制剂; 眼用制剂; 仿制药质量与疗效一致性评价
正文 |
《国务院关于改革药品医疗器械审评审批制度的意见》( 国发〔2015〕44 号) 文中指出,对已经批准上市的仿制药分期分批进行质量一致性评价。
眼用制剂通常用局部给药的方式,一般没有全身性吸收,因而已确立的用于评价口服固体制剂药物生物等效性的体内药动学研究方法并不适用于眼用制剂。
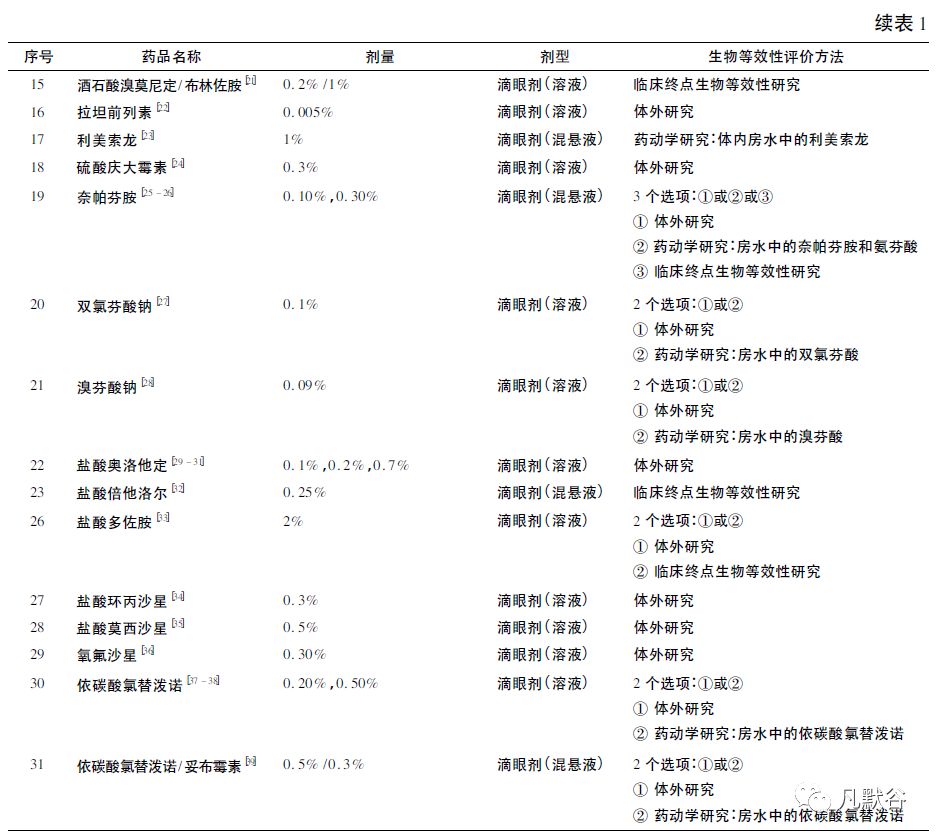
目前一致性评价中备案参比制剂的眼科用药共有吡嘧司特钾滴眼液、加替沙星滴眼液、拉坦前列素滴眼液、拉坦噻吗滴眼液、阿昔洛韦滴眼液和氧氟沙星滴眼液6 个品种。
截至2018 年10 月20 日,FDA 在其网站中已公布了1 445 个特定品种的生物等效性指导意见,眼用制剂的指导原则有30 个品种共37 个指导原则草案。
其中一致性评价备案的氧氟沙星滴眼液、拉坦前列素滴眼液和加替沙星滴眼液等品种可参考FDA 的特定品种生物等效性指导意见,开展与参比制剂的对比研究。
本文分析了FDA 颁布的《特定品种生物等效性指导原则》中眼用制剂特定品种的生物等效性指导原则,以期为建立我国的该类特定品种生物等效性指导原则提供借鉴依据。
1
眼用制剂的特性
眼用制剂系指直接用于眼部发挥治疗作用的无菌制剂[1]。
眼用制剂可分为眼用液体制剂( 滴眼剂、洗眼剂、眼内注射溶液等) 、眼用半固体制剂( 眼膏剂、眼用乳膏剂、眼用凝胶剂等) 、眼用固体制剂( 眼膜剂、眼丸剂、眼内插入剂等) 。
眼用液体制剂也可以固态形式包装,另备有溶剂在临用前配成溶液或混悬液。
眼暴露于体表,通常用局部给药的方式,因此眼部药动学有其自身的特点。
眼用制剂一方面通过结膜囊的局部毛细血管进入全身循环,另一方面,泪液在眼表的更新速度为1 μL·min-1C,大部分的滴眼剂可在数分钟之内随着泪液的循环快速流入鼻泪管,从而经鼻腔黏膜进入全身循环[2]。
2
眼用制剂的生物等效性试验方法
FDA《特定药物的生物等效性指导原则》推荐的眼用制剂生物等效性试验方案大概分为3 种:
① 体外实验。
② 以药动学为终点的体内生物等效性试验。
③ 临床终点生物等效性试验。不同品种推荐方法见表1。

对于局部起效的溶液型眼用制剂,如果其化学性质和制造过程都足以证明生物等效性,可通过体外试验给予体内生物等效性研究豁免。
有些品种可以开展类似口服固体制剂的以药动学为终点的体内生物等效性试验,通过检测眼局部靶组织的药物浓度,计算药动学参数评价仿制制剂与参比制剂的等效性。
对于一些局部起效的眼用制剂,没有确定的药效学标志物,但具有可接受的临床终点指标或替代终点指标,只能采用临床终点生物等效性试验评价仿制制剂和参比制剂的等效性。
2.1 体外实验
体外实验应考察仿制制剂与参比制剂关键质量属性的一致性,包括但不限于以下内容: 理化性质( 如性状、比重、渗透压摩尔浓度、pH值/酸碱度、缓冲能力等) ,相对流变特性( 剪切力/黏度) ,体外溶出/释放行为,沉降体积比等。
混悬剂、膏剂等还需使用群体生物等效性( populationbioequivalence,PBE) 统计方法考察粒径及其分布的相似性。
对于通过体外实验豁免体内试验的眼用制剂,需要分别对3 批仿制制剂和3 批参比制剂进行定性( Q1) 、定量( Q2) 和理化性质( Q3) 的一致性研究。
其中Q1 一致指仿制制剂与参比制剂使用相同的辅料,Q2 一致指辅料含量与参比制剂相比在± 5% 范围之内。
3 批仿制样品的规模均应不少于商业化生产规模的1 /10 并能够反映商业批次的生产过程。
对于眼用制剂,FDA 指出如果与参比制剂相比较,仿制制剂不符合Q1 和Q2 一致的要求,均需要进行体内生物等效性试验研究。
对于在处方中加入抑菌剂的眼用制剂还需要进行与参比制剂相比较的体外抑菌效力研究。
以妥布霉素滴眼液为例,其为多剂量包装,这种制剂包装形式一旦开封后容易在使用和保存过程中被泪液及空气中的微生物污染,从而产生安全隐患,处方中会加入苯扎氯铵、羟苯甲酯、羟苯乙酯等抑菌剂。
FDA指导原则中要求比较妥布霉素滴眼液仿制制剂和参比制剂的抑菌效力,测试用微生物应包括所有在USP 防腐剂抑菌效力中列出的微生物和参比制剂说明书“适应证”部分列出的所有微生物。
实验中妥布霉素的抗菌活性与对照品的抗菌活性应在体外至少与以下17 种微生物进行对比研究,包括白色念珠菌( Candida albicans) 、黑曲霉( Aspergillus niger) 、大肠杆菌( Escherichia coli) 、铜绿假单胞菌( Pseudomonasaeruginosa) 、金黄色葡萄球菌( Staphylococcusaureus) 、表皮葡萄球菌( Staphylococcus epidermidis) 、肺炎链球菌( Streptococcus pneumoniae) 、克雷伯氏肺炎菌( Klebsiella pneumoniae) 、产气肠杆菌( Enterobacteraerogenes) 、奇异变形杆菌( Proteus mirabilis) 、摩氏摩根菌( Morganella morganii) 、普通变形杆菌( Proteus vulgaris) 、流感嗜血杆菌( Haemophilus influenzae)、埃及嗜血杆菌( Haemophilus aegyptius) 、结膜炎莫拉菌( Moraxella lacunata) 、不动杆菌( Acinetobactercalcoaceticus) 、深黄奈瑟氏菌( Neisseria perflava)或干燥奈瑟球菌( Neisseria sicca) 。
体外抑菌研究中针对每种微生物应进行至少包含12 个平行数据的研究,以证明仿制制剂和参比制剂之间的生物等效性。
一些微乳化的眼用制剂可增加药物在眼部的滞留时间从而提高生物利用度,指南中对这类品种还要求进行仿制制剂和参比制剂的体外释放速率对比研究,涉及的品种有: 地塞米松/硫酸新霉素硫酸多黏菌素B 眼膏剂、地塞米松/妥布霉素滴眼剂、依碳酸氯替泼诺滴眼剂、依碳酸氯替泼诺/妥布霉素滴眼剂、利美索龙滴眼剂、奈帕芬胺滴眼剂、醋酸泼尼松龙滴眼剂和布林佐胺滴眼剂。
目前这类品种体外释药行为的考察方法有正向透析袋法、反向透析袋法、扩散池法等,释放介质常选用模拟人工泪液[40]。
2.2 以药动学为终点评价指标的生物等效性试验
对于以药动学为终点的体内生物等效性试验,眼用制剂与口服固体制剂的设计类似[41 - 42],大部分为单次给药、双向交叉或平行试验设计; 眼用制剂不建议采用部分或完全重复交叉设计体内试验,受试者均选取患者进行。
建议以药动学为终点评价指标而进行生物等效性评价的品种见表1。
一般推荐测定原形药物,除原形药物外还需要检测代谢物的品种有:奈帕芬胺滴眼剂需检测奈帕芬胺和氨芬酸,二氟泼尼酯眼用乳膏剂需检测二氟泼尼酯及代谢物DFB。
以依碳酸氯替泼诺滴眼剂为例介绍以药动学为终点的体内生物等效性试验。
进行生物等效性试验入组的受试者为准备进行白内障手术并在术前已接受眼科皮质激素治疗的患者。
在进行白内障切除手术前,采取下结膜囊给药方式,给予1 次剂量的仿制制剂或参比制剂。
在指定的采样时间点,从每个受试者的1 只眼睛中只采集1 份房水样本。
申请人可考虑采用平行设计进行生物等效性研究。
如果采用平行研究设计,每位患者只应接受1 种治疗,仿制制剂或参比制剂,但不能同时接受2 种。
交叉研究设计可以用于接受双眼白内障手术的患者。
当采用交叉研究设计时,每个患者都应该接受仿制制剂和参比制剂治疗。
交叉研究的洗脱期不应超过35 d。
碍于方法所限,房水采集所获数据量通常较少,有时需应用群体药动学的方法对吸收速率相关参数峰浓度( Cmax) 和吸收程度相关参数药时曲线下面积( AUC) 进行分析。
建议采用以下统计模型: 使用每个时间点t 的平均浓度( Ct) 计算每个产品的平均AUCt和测量时间点t,得出每个产品的平均药时曲线。
根据梯形规则,采用加权线性组合的方法计算平均AUCt。
AUCt是从0 时到时间t 的浓度-时间曲线下面积。一般来说,我们有j 浓度下,测量点有t1< t2 < t3…,< tj( t1 > 0) 。
每次仿制制剂和参比制剂的AUCt之比( Rt) 用于评估每次试验的生物等效性。
Rt 的标准差可以通过Bootstrapping 算法或参数法计算。
如果Rt 的90%置信区间( Rt ± 1. 645) 位于( 0. 80,1. 25) 的范围内,则说明仿制制剂与参比制剂生物等效。
Bootstrapping算法或参数法可用于计算Cmax和Tmax,并评估Cmax的生物等效性。
正常情况下人体房水不能直接采集,但在常规白内障手术中按照时间点提取患者少量房水样本是方便且安全的。
需要注意的是,房水样本具有取样量少、浓度低、内源性物质干扰多以及个体差异大等特点,因此必须建立灵敏、专一、精确、可靠的样品定量分析方法。
方法学确证是整个眼部药动学研究的基础和关键,只有建立准确可靠的方法才能得出可信度高的结果。
2.3 临床终点生物等效性试验
临床终点生物等效性研究的目的在于证明仿制制剂和参比制剂的治疗效果等同,并表明这两者均优于安慰剂。
临床终点指标的选择及其测量时机的选择对于研究结果的灵敏度和准确性非常关键。
受试患者、疾病状态、生物标志物和治疗过程的不确定性和变异性,对试验的成功与否有着很大的挑战。
临床终点生物等效性研究通常采用随机、置盲、双臂的平行设计,研究通常进行数周。
使用安慰剂臂可以确保研究是在足够敏感的剂量下开展,以保证达到一定效果,并且可以检测到2 种治疗间的差异,如奈帕芬胺滴眼液,根据评分量表、治愈( 完全消退) 或失败( 未消退) 量表判定二分终点,通过肉眼观察对大多数临床终点进行评估,通过对数据进行统计学分析,药品差异的90%置信区间必须在( - 0. 20,+ 0. 20) 内。
有些品种是基于连续变量,根据自基线处的平均变化进行统计学分析来确定生物等效性,仿制制剂和参比制剂平均比率的90%置信区间在( 0. 80,1. 25) 内。
以奈帕芬胺滴眼液为例介绍采用量表判定二分终点的生物等效性研究。
奈帕芬胺滴眼液在准备进行白内障手术并在手术之前已接受眼科皮质激素治疗的男性和非孕女性患者中开展临床终点生物等效性试验,采用随机、双盲、安慰剂对照的平行设计。
给药时间点为手术前1 d、手术当天和术后的前2 周( 术后1 ~ 14 d) ,qd。建议治疗时间为16 d,在筛查、术后d 1、术后d 7 和术后d 14 到门诊就诊。
为安全起见,建议在术后d 7 和d 14 到访时测量视力。
虹膜色素沉着的多少会影响前房炎症的消退速度,建议在分组时检查各组的虹膜色素沉着[浅色( 蓝色、灰色、淡褐色) 或深色( 棕色) 虹膜]程度大致平衡。
研究方案对联合用药及在研究期间禁止的处方和非处方药物进行了详细描述。
研究建议的主要终点是术后d 14 治愈的受试者的比例,采用评分表进行打分,其中治愈的房水细胞( aqueous cells) 评分为0,水肿评分为0,疼痛评分不超过3。
对于二分类变量( 治愈与失败) 的等价性检验,建议采用以下统计分析方法。
仿制制剂和参比制剂之间成功比例差异的90% 置信区间必须在( - 0. 20,+ 0. 20) 内,方可证明其等效。
假设检验为H0: pT - pR < - 0. 20 或pT - pR > 0. 20 与HA: - 0. 20 < pT - pR < 0. 20,其中pT = 仿制制剂治疗组成功率,pR = 参比制剂治疗组成功率。
设定nT = 仿制制剂治疗组的样本量, cnT =仿制制剂治疗组成功次数,nR = 参比制剂治疗组的样本量, cnR = 参比制剂治疗组成功病例数。
采用Yates'correction 方法,计算仿制制剂和参比制剂之间成功比例差异的90% 置信区间。
如果L≥ - 0.20并且U≤0.20,则拒绝H0。拒绝零假设H0,证明仿制制剂和参比制剂等效。
鉴于眼用制剂的生物等效性试验与普通口服固体制剂相比,存在试验设计复杂、周期长、难度大、对临床试验机构及分析测试机构要求高等特点,建议在开展眼用制剂仿制药的研发和再评价工作时,应先重点进行仿制药品与参比制剂的处方工艺比较以及深入的质量对比研究,再开展体内试验研究。
目前备案的眼用制剂中还有个别品种没有可以参考的特定品种生物等效性指南,建议参考FDA 网站上相关品种的参比制剂上市时申报资料中的相关内容开展研究。
中国食品药品检定研究院对以上眼用制剂的生物等效性指导建议进行了翻译[43],将会分批在网站上发布,以期对建立我国的眼用制剂生物等效性指导原则和下一阶段一致性评价工作的顺利开展提供借鉴和帮助。