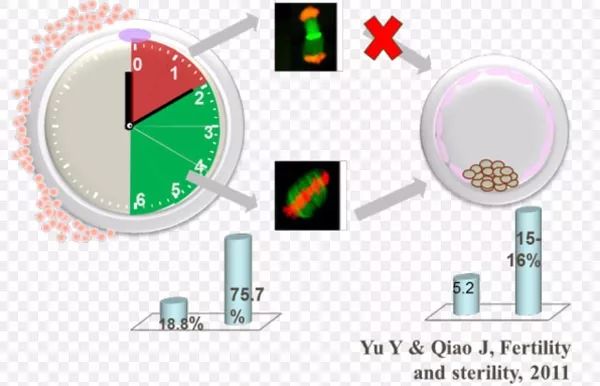
人类未成熟卵母细胞体外成熟(in vitro maturation,IVM)是人类生殖研究的一项常用技术,该技术不需超促排卵或仅应用少量促性腺激素,直接从卵巢中采取未经体内成熟的卵母细胞,在体外经过适宜的条件进行成熟培养,使其具备受精能力。未成熟卵母细胞的成熟过程是发生生发泡破裂(germina lvesicle break down,GVBD)恢复完成第一次减数分裂进入并停滞于第二次减数分裂中期的过程。卵母细胞成熟是良好体外受精的前提,因而把握成熟时机是关键。关于恢复减数分裂后的核事件进程,虽在多种哺乳动物中都有研究,但由于长期以来人类卵母细胞来源缺乏,目前尚无相关的细致分期研究报道,IVM技术为研究人类未成熟卵母细胞体外成熟过程提供了良好机会,使揭示人类的生殖奥秘成为可能。
于未刺激周期多囊卵巢患者行B超监测下穿刺取卵,从窦卵泡中取出未成熟卵母细胞进行IVM后体外受精,既可减轻病情,又能防止促排卵药物不良反应,是目前对多囊卵巢患者最有效且治疗效果最佳的手段之一,本实验选择GV清晰的COCs,置M199组织培养液中培养,并加以卵细胞成熟必需的E2、FSH、HCG等,观察了各分裂时相核染色体的形态改变,首次对人类卵母细胞体外培养成熟的减数分裂进程作了较为细致的描述,为进行其他探索人类生殖奥秘的研究奠定了基础。在人体内,黄体生成素(luteinizing hormone,LH)峰后的24~30h,卵母细胞排出第一极体;本研究中体外培养28h后近70%的GV期卵母细胞发育成熟,这与体内的成熟进程基本一致,上述培养条件下成熟的卵母细胞同样可以体外受精并发育成胚胎,其生物学意义显而易见。从GVBD后抑制成熟因子的撤退,减数分裂调控蛋白和促成熟蛋白的逐渐表达,至精卵结合相关肽及蛋白的成熟,都与减数分裂分期密切相关。目前人类卵母细胞IVM技术中存在的问题是体外成熟率和受精率较低,所以研究改善体外培养微环境提高成熟率是众多生殖学家的心愿,而促体外成熟的机制研究都离不开减数分裂各时相的确定,故希望本研究能够为之提供一定的生物学理论依据。
在恢复减数分裂的各期,测量卵母细胞直径,GV、M-I、M-II期直径分别为106173+/-2106Lm、108135+/-2135Lm、108185+/-1196Lm,这与Dorota等所测猪卵母细胞各期直径变化规律有相似之处,但各期间无显著性差异。这可能是由于培养液中促性腺激素的加入,使卵丘细胞与卵母细胞间的功能联系较快终止,这样虽能诱发减数分裂的恢复,但另一方面却不能向卵母细胞输送大量物质,使体外成熟卵母细胞直径比体内成熟卵母细胞直径小。卵母细胞直径与卵泡大小及卵母细胞成熟潜力成正相关,因此人未成熟卵IVM成熟率低与其卵母细胞直径小有关。
显微操作技术的发展和基因敲除小鼠的应用为卵母细胞成熟调控机制的研究提供了有利条件,取得了突破性的进展。对于卵母细胞发育及成熟的研究不仅具有重要的理论意义,而且具有较强的实践意义。无论是在推进畜牧业生产产业化方面还是在辅助生殖生物学中,体外成熟、体外受精和胚胎移植技术的运用都越来越显现出其重要性。然而卵母细胞在体内发育过程中的一些调节机制尚不明确,对卵母细胞成熟过程起调节作用的因素仍是研究的热点。
人卵母细胞在胚胎第8周时就开始第一次减数分裂,出生时初级卵母细胞已经过第一次减数分裂前期,在酪氨酸激酶配体(tyrosinekinaseligand,KL)/c-kit基因编译受体信号途径、细胞静止因子(cyto static factor,CSF)、环磷酸腺苷(cAMP)的作用下,长期停留在前期和中期之间的静止期;直至青春期在适当激素环境下,引发原来静止的减数分裂重新恢复,完成第一次减数分裂,形成次级卵母细胞和第一极体;次级卵母细胞于排卵前停留在第二次减数分裂中期,受精后完成第二次减数分裂。卵母细胞成熟的调控并不是一个单纯的级链式作用,而是一个非常复杂的多因子调节过程。
G蛋白耦联受体介导的信号通路(包括cAMP信号通路和磷脂酰肌醇信号通路)和受体酪氨酸激酶(receptor tyrosine kinase,RTK)-Ras蛋白信号通路是细胞信号传递过程中两条重要的途径,而这些途径某些环节中的蛋白降解过程又涉及到泛素-蛋白酶体途径。通过描述这两条信号通路中关键蛋白及细胞因子的作用,阐明卵母细胞减数分裂的调控机制。
人卵母细胞成熟过程的许多调控机制还存在争议和未知领域。如果能比较全面地阐明人卵母细胞发育的调控机制,将为女性内分泌疾病和不孕症的治疗提供理论依据。未成熟人卵母细胞体外成熟技术已成为治疗不孕症的新途径,是目前生殖医学领域日益热门和关注的课题。有必要对卵子的发育成熟机制进行深入探讨,提高胚胎质量,使辅助生殖技术更好地为人类服务。