20191025 周五
Food Hydrocolloids (IF: 5.839,2区)
推荐人|朱俊向
内容介绍
●研究背景
姜黄素是从姜黄的根茎中提取的天然亲脂性抗氧化剂。尽管姜黄素生物活性优良,但水溶性差、化学不稳定性和生物利用度低,限制了其在食品、化妆品和其他行业中的应用。为了克服上述障碍,众多学者尝试将其包裹在纳米颗粒、脂质体、聚合物胶束和水凝胶等载体中。肌肉蛋白质在这方面具有巨大的潜力,可以作为一种新的递送载体制备原料,与谷物、牛奶或豆类中的蛋白质相比,肉类蛋白质具有所有必需氨基酸和更高的消化率。然而,关于肌肉蛋白作为多酚载体的报道很少。该课题组最近研究表明,姜黄素可以很好地被封装在肌原纤维蛋白中,形成纳米复合物,其稳定性和生物利用度大大提高。肌球蛋白,作为肌原纤维蛋白重要的组成部分,与姜黄素相互作用机制如何?是值得进一步思考和研究的问题。
●研究方法
通过紫外-可见光谱表征姜黄素/(鸡肉)肌球蛋白复合物;通过荧光光谱研究淬灭机制;通过圆二色谱(CD)研究姜黄素结合对肌球蛋白二级结构的影响;最后,通过同源建模构建肌球蛋白(重链)的合理模型,模型质量由拉氏图和ERRAT 评价;通过分子动力学(MD)模拟探讨姜黄素与肌球蛋白之间的相互作用机制(结合位点和键和模式)。
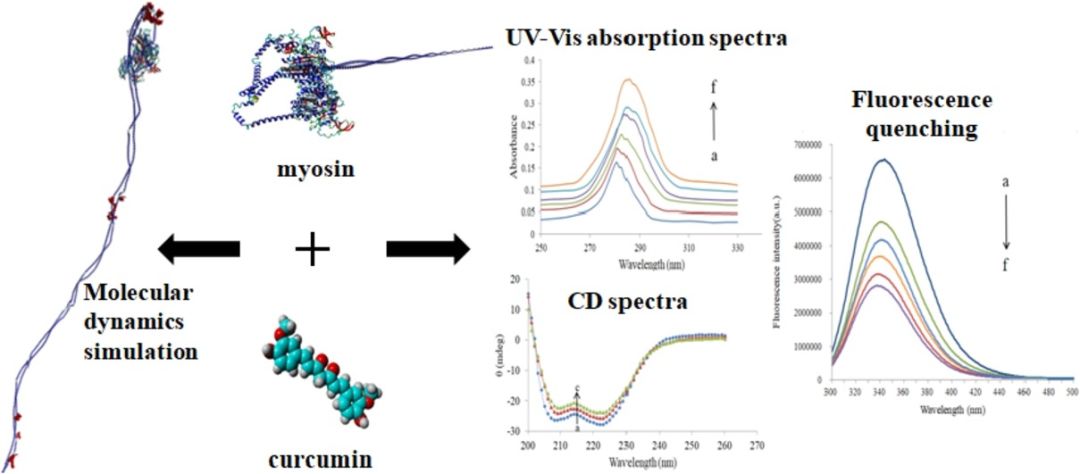
●研究结果
姜黄素和肌球蛋白的复合物形成通过紫外-可见吸收光谱证实。荧光数据表明姜黄素与肌球蛋白的结合是一个静态淬灭过程,结合常数在105 M-1范围内,表明姜黄素与肌球蛋白之间具有强亲和力。CD研究表明姜黄素与肌球蛋白的相互作用引起蛋白质二级结构的轻微变化,这与MD观察结果一致,该现象也说明姜黄素诱导的构象变化仅限于结合位点,并不涉及蛋白质折叠的显著变化。此外,通过同源建模得到了(鸡肉)肌球蛋白重链的合理构象,进一步,由MD技术观察到疏水相互作用和氢键驱动姜黄素-肌球蛋白复合物形成。MD模拟结果还表明,姜黄素在整个结合过程中倾向于与肌球蛋白重链头部区域801-850,A链1156-1195和1739-1743,B链1162-1218和1736-1745残基结合。
●研究结论
该工作揭示了姜黄素与肌球蛋白相互作用的机理,对以肌肉蛋白质为载体材料开发姜黄素递送体系具有重要理论指导意义。
推荐理由
目前,通过实验方法研究一些分子间互作机制存在较大困难。但近年来,随着理论模拟力场的不断开发和计算机处理能力的突飞猛进,基于分子力学开发的分子对接和分子动力学模拟等技术已成为研究分子间作用机制的重要手段。这两种技术可将不同分子间相互作用及动态变化过程形象化,从微观层次上解释宏观物理和化学变化过程,为实验结果提供有力理论支持。近期,Chen等人(doi: 10.1111/1541-4337.12406)综述了目前分子动力学模拟在食品领域的应用,包括(1)水和盐与蛋白质、碳水化合物和脂质之间相互作用;(2)蛋白质、碳水化合物、脂质和生物活性物质之间的相互作用;(2)加工条件(压力、温度、脉冲电场)对食品组分的影响。今后,相信随着力场的不断发展和完善,分子模拟将适用于更多的食品体系,在食品科学基础研究方面发挥重要作用。

