20191025 周五
Food Function (IF:3.24,1区)
推荐人|温敏
内容介绍
●研究背景
球状蛋白是两亲性大分子,在食品工业中广泛用作泡沫和乳化剂。天然的β乳球蛋白 (NGBLG)是球状蛋白质,在牛奶中含量丰富,因其营养功能及加工特性在食品工业中受到关注。
已有一些关于天然蛋白制备的纳米蛋白或纤维的发泡或乳化特性的研究。然而,在可比较的条件下,在空气、水和油水界面特性方面,迄今为止还没有对天然的、纳米级的和纤维状的蛋白质进行直接和系统的比较。一般认为,加热或加压引起的蛋白质聚集是不可逆的,聚集物的大小与蛋白质的浓度有关。该研究以乳清蛋白的主要成分NGBLG为研究对象,对其在不同pH值下聚集前后的发泡和乳化性能进行了对比研究。
●研究方法
通过调节pH和温度来制备β乳球蛋白纳米颗粒(BLGNPs)和β乳球蛋白原纤维(BLGFs),并在pH值7.0和pH值4.0条件下与天然的球状β乳球蛋白 (NGBLG)比较其发泡、乳化性能。通过泡沫分析仪、微粒子分析仪、界面流变仪和原子力显微镜表征泡沫/乳化功能和界面微观结构/机械性能。通过测定泡沫高度的衰减和乳化液液滴大小的变化评价泡沫和乳化液的稳定性。
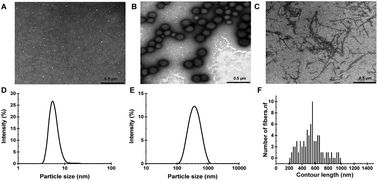
●研究结果
泡沫和乳化液的稳定性都是BLGFs > NGBLG > BLGNPs。泡沫在pH值4.0时更稳定,而乳液在pH值下更稳定7.0。NGBLG及其团聚体在pH值4.0时的表面扩张模量(E)大于其在pH值7.0时, BLGFs的E值最高,因此对膜损伤的抵抗力最高。用NGBLG及其团聚体制备的乳状液在pH 7.0时的负电荷比在pH 4.0时多。泡沫稳定性受界面弹性的影响较大,而乳液稳定性受界面弹性的影响较小是由表面电荷决定的。AFM分析结果表明,在pH 4.0 ~ 7.0之间不同蛋白质聚集体在空气-水界面呈现不同的微观结构,很好地解释了它们的发泡和乳化特性。
●研究结论
该研究系统地比较NGBLG及其团聚体(BLGNPs和BLGFs)的发泡和乳化性能。作者清楚地证明了NGBLG及其聚集体在不同pH条件下的发泡和乳化性能的差异。
结果表明,NGBLG及其团聚体在pH 7.0时的乳化稳定性较好,而在pH 4.0时的泡沫稳定性较好。NGBLG及其团聚体的发泡和乳化稳定性依次为:BLGFs > NGBLG > BLGNPs,说明将NGBLG加热制备BLGFs,而不是BLGNPs,可以有效提高蛋白质的发泡和乳化性能。因此,BLGFs可以作为一种很有前途的起泡乳化剂应用于食品工业。
原文链接
Comparative study on foaming and emulsifying properties of different beta-lactoglobulin aggregates. By Jing Hu, Jixin Yang, Yao Xu, Ke Zhang, Katsuyoshi Nishinari, Glyn O. Phillips and Yapeng Fang*(2019) https://pubs.rsc.org/en/content/articlelanding/2019/fo/c9fo00940j#!divAbstract
相关研究
学者简介
方亚鹏
方亚鹏,博士、上海交通大学教授、博士生导师,国家优秀青年科学基金获得者。入选国家“万人计划”科技创新领军人才、科技部中青年科技创新领军人才、教育部新世纪优秀人才支持计划、湖北省“楚天学者计划”、“百人计划”、湖北省新世纪高层次人才工程第一层次人选等。担任《Food Hydrocolloids》、《食品科学》、《食品工业科技》等杂志编委、国际亲水胶体大会咨询委员、中国食品科技学会青年工作委员会委员、湖北省生物物理学会常务理事等。研究方向:食品胶体科学1、食品胶体功能与应用;2、食品软物质物理;3、食品结构-营养品质关联


