郑晓洁,李思泽,袁雅文,金莎莎,李敏,相小强
上海中医药大学附属曙光医院
复旦大学药学院
摘要
生理药代动力学(physiologically based pharmacokinetic, PBPK) 模型是预测药物在特殊人群中的药代动力学、药效学和安全性的重要工具。
尤其对于儿童这类不易开展临床试验的人群,PBPK模型的应用更是能有效促进儿科药物的开发以及儿童的临床用药。
目前,PBPK模型在儿科药物开发中的主要应用有以下几种:临床试验设计、药物相互作用(drug-drug interaction, DDI)的风险评估和儿童给药剂量的确立等。
本综述简介了儿童生理药动学模型在儿科药物研究中的优越性,总结了PBPK模型如何实现从成人到儿童的外推,儿童生理药动学模型的理论基础,建模过程及所要注意的重要生理参数,列举了目前PBPK模型在儿科药物研究中的一些应用实例。
最后简述了儿童PBPK模型当前的局限性和未来发展方向。
关键词
儿科药物;生理药代动力学模型;药物相互作用
正文 |
1
儿童生理药代动力学(PBPK)模型介绍
生理药代动力学(PBPK)模型是在生理学知识基础上,采用数学模型的方法,定量预测人体或动物体内药物的药代动力学特征(吸收、分布、代谢、排泄)的一种先进技术[1, 2]。
PBPK模型将系统特异性因素(例如机体的身高体重、肝肾功能差异等)与药物特异性因素(清除率、分布容积、代谢途径等)结合起来,从而可以预测药物在不同人群中的药代动力学特征。
儿科药物的开发与研究一直以来受到伦理因素的限制。
由于儿童的临床试验通常志愿者较少,且对于非治疗目的的干预手段有一定限制,所以儿童临床试验的样本量,以及试验终点都会受到影响,从而限制了儿童临床试验的开展及儿科药物开发[3]。
很长一段时间,儿童用药的指导都是采用基于体重、年龄和体表面积的换算方式,从成人的剂量来推算儿童用药的剂量[4, 5]。
然而,儿童并不是缩小版的成人,决定儿科药物效应的因素不仅多元而且复杂[6]。
当药物的吸收和处置过程变得复杂时,这种简单的算法往往无法准确预测体内器官真实的发育程度而导致错误估计儿童体内的药物暴露量[7]。
而PBPK模型可以通过数学模型预测儿童的生长和器官成熟程度,建立不同年龄段的虚拟人群。
通过药物在健康成人受试者中吸收处置的特征,与建立的虚拟儿童人群相结合,从而可以实现成人至儿童的外推以预测药物在儿童体内的药代动力学特征[4, 8]。
与传统的方法相比较,器官的生长发育过程在PBPK模型中得到更好的还原,大大提高了预测的准确性以及安全性。
美国食品和药物监督管理局(Food and Drug Administration, FDA)监管的一份研究中总结了2008~2017年PBPK建模在94例新药申报中的应用分布(图1)[9]。
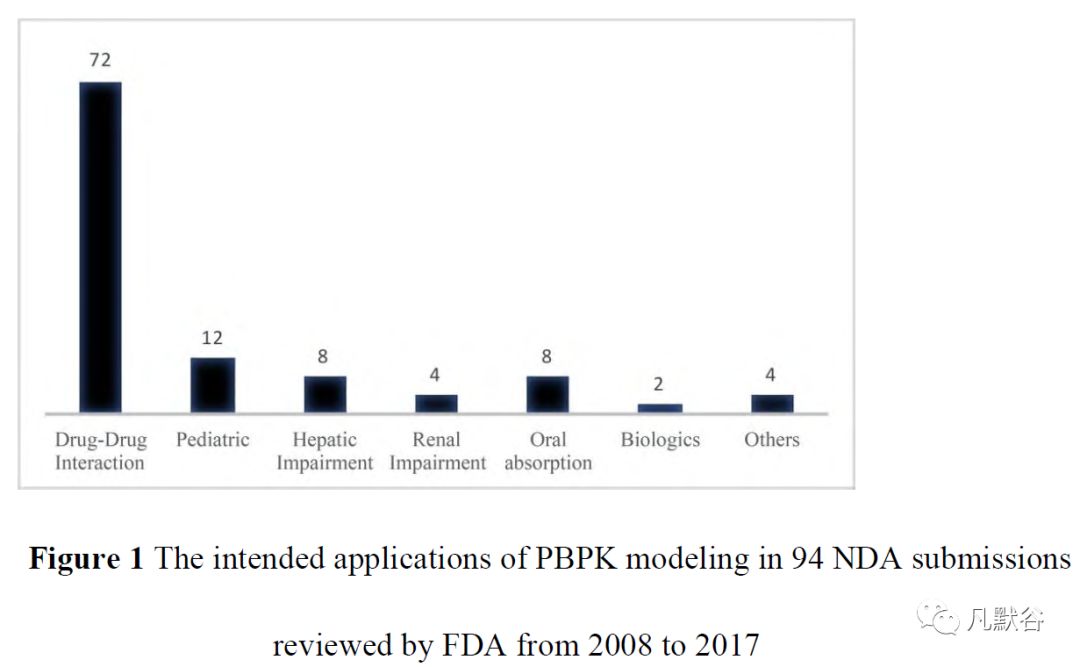
其中,第二多的应用便是儿科药物开发,仅次于药物相互作用的研究,由此可以看到该技术在儿科药物开发中的重要性[4, 9]。
目前,PBPK模型在儿童药物开发中主要用于辅助儿科药物临床试验的设计[10],儿童首剂量的确定[11],以及靶器官毒性预测等方面[12]。
2
儿童生理药动学模型建立的理论基础
儿童与成人相比,身体处在一个生长发育的阶段,因此年龄会影响儿童的生理状态,导致药物处置产生差异。
机体的发育看起来是一个连续的过程,很难准确捕捉儿童生长发育的界限。
儿童的生长发育过程,是许多高度复杂的器官成熟过程结合在一起的,并且这些并行的发育过程,还会遵循不同的时间发展轨迹。
因此,为了建立描述药物在儿童体内药代动力学过程的PBPK模型,需要了解发育过程对药物吸收、分布、代谢和消除的具体影响,并将所有因素整合到PBPK模型中,进行定性和定量评估[4]。
儿童PBPK模型是一个从成人PBPK模型外推的过程。
因此,为了使这个外推过程成立,需要人为地规定了一些假设[7]:
①药物在儿童以及成人体内的清除途径相同,差异仅体现在清除率大小上;
②假设儿童的PBPK模型结构与成人PBPK模型结构一致,这样才可以进行有效的外推;
③疾病状态下的儿童与正常儿童相比,发育水平不受影响(除去目前已知对儿童发育有影响的疾病);
④除了与年龄相关的药物/系统特异性参数,其余参数在成人和儿童PBPK模型中保持不变。
儿童PBPK模型建立的一般步骤如图2所示,首先建立该药物成人的PBPK模型并验证,然后再通过改变年龄相关的系统参数,从而建立药物在儿童体内的PBPK模型。
之所以要建立成人的PBPK模型,首先这样有助于对药物体内过程的全面认识,其次是因为成人的临床数据多,方便验证模型的可靠性。
需要注意的是,由于成人与儿童PBPK模型具有高度的相似性,因此成人PBPK模型中存在的问题也可能会传递至儿童PBPK模型中。
因此借助成人的富集数据,在建模的过程中,尽可能较早发现模型中的问题,并及时改正,以提高模型预测的准确性[14]。
在从成人到儿童模型的建立过程中,需要时刻注意关键参数随年龄的变化,例如(器官的体积和酶的表达量等),这些参数将成为影响模型预测能力的重要因素[15]。
儿童PBPK模型的检验方式与成人模型也大致相同,所以在建立成人PBPK模型的时候,通过了解成人模型存在的问题,也可以较好地把握儿童PBPK模型预测过程中的优势与应用局限[16]。
2.1 从成人到儿童的生理参数
儿童的PBPK模型是从成人的PBPK模型外推而来。因此,儿童PBPK模型与成人的PBPK模型的基本构架是一致的。
某一特定药物的PBPK模型包括两大类参数:药物特异性参数以及系统特异性参数。
其中药物特异性参数包含:药物的理化性质、血浆蛋白结合率、表观分布容积、酶的固有清除率和转运体对药物的作用等。
系统特异性参数则包含了血流速度、器官大小和酶的表达量等。
其中,部分系统性参数会随着年龄和发育而改变,这将会导致儿童与成人间的药代动力学过程有很大区别。
例如:肝肾清除率、血浆蛋白结合率、药物的表观分布容积、酶的表达等。
2.2 儿童的蛋白结合率与胃肠道生理参数
儿童器官的成熟是一个漫长的过程。在发育的过程中,许多影响药代动力学的参数会随着年龄的增长而改变,如血浆蛋白结合率与胃肠道生理参数。
血浆蛋白结合是药物分布的一个重要的过程,而与血浆蛋白结合密切相关的两种蛋白,白蛋白(albumin, Alb)以及α-酸性糖蛋白(α1-acid glycoprotein, α1-AG)的体内含量都会随着年龄的增长而发生改变。
它们随着年龄的变化规律如式1,2所描述[17-21]。在体内只有游离的药物才能在体内透膜转运以及发挥疗效。
当知道了血浆蛋白在儿童体内的浓度,便可以预测游离药物在儿童体内的百分比(fu),见式3[18]。
式3中,[P]Pediatric和[P]adult分别代表儿童和成人体内的血浆蛋白浓度。
药物的吸收以及胃排空的时间也会受胃肠道的发育影响。
随着年龄的增长,胃肠道pH值、胃肠液的组成、小肠的直径和长度都会发生变化。
根据国际放射防护委员会的研究(International Commission on Radiological Protection, ICRP)[22,23],小肠的直径和长度随体表面积(BSA)的增加呈线性增长,见式4和5。
然而,最近的研究指出,药物在小肠中的保留时间以及胃排空时间与年龄的增长没有相关性[24]。
随着年龄的变化,胃肠液组成的改变会改变药物在胃肠道中的溶解度[25],这也有可能导致儿童对药物吸收与成人存在差异。
2.3 儿童的肝脏清除率参数
肝脏是药物代谢最重要的器官,相关生理参数会随年龄发生较大变化。
随着年龄的增长,肝脏的体积会增大,这会间接影响肝脏中肝细胞的数量以及相关药物的代谢。
根据Johnson等[26]的研究,肝脏从新生儿至成年,体积的变化符合一定的规律(式6)。
但是这种只考虑器官体积增长的方式,并不能准确描述药物的肝脏代谢随年龄变化的规律。决定肝脏代谢能力的不仅仅是肝脏的体积,肝脏中代谢酶的表达同样也是肝脏清除能力重要的决定因素。
随着肝脏的成熟,肝脏内各种药物代谢酶的表达也会随着年龄的增长而改变。
Johnsrud等[27, 28]用数学的手段发现肝脏内细胞色素酶P450(CYP)2E1从新生儿到成人的变化规律(式7)。
CYP2E1 Hyperbolic function指的是某年龄下CYP2E1酶的丰度与成年人酶丰度的比值。
可以看到,随着年龄的增长,儿童体内的CYP2E1酶的表达在不断地增长。
当确定儿科药物代谢酶的表达量之后,可以预测通过这种酶代谢的药物的肝脏清除率。
举个例子,Nong等[29]就是通过CYP2E1在儿童体内表达量从而去预测甲苯在儿童体内的固有清除率(CLint-child)(式8)。
式8中[CYP2E1]child和[CYP2E1]adult代表了该代谢酶在儿童和成人体内的表达量,而Vliver-adult和Vliver-child则是成人和儿童的肝脏体积。
再通过儿童肝脏对甲苯的固有清除率去预测甲苯的肝脏清除率(CLh)(式9),式中QL是肝脏的血流量。
肝脏内表达的转运体对药物的处置过程也起到了不容忽视的作用,并且转运体的表达也呈现出随年龄发育的趋势,但目前缺乏相关的研究数据,因此对转运体发育规律的认识尚不明晰[30]。
未来的研究需要了解转运蛋白的个体发育规律,能够将转运蛋白发育的因素和成人模型结合,从而外推到儿童PBPK模型,使预测结果更加准确。
2.4 儿童的肾功能参数
肾脏是人体内主要的排泄器官之一,大部分药物都是经过肾脏排出体外的。
选取正确的儿童肾功能的相关生理参数对儿童生理模型的合理性来说非常重要。
新生儿的肾脏功能是不成熟的,随着机体的生长发育,儿童的肾功能也会逐渐发育。
目前为止,定义肾功能的指标主要有两个:肾小球滤过率(glomerular filtration rate, GFR)以及肌酐清除率。
肾小球清除率随体表面积的增长会发生相应的改变(式10)[22]。
通过式10可预测不同年龄阶段儿童的肾小球滤过率,继而可预测药物在儿童体内经肾小球滤过的固有清除率(式11)[31]。
式11中,GFRchild和GFRadult是成人群体或儿童群体的肾小球滤过率,而CLint,GF是指某药物肾小球滤过的固有清除率。
当肾小管分泌成为肾脏排泄的一个影响因素时,也可以使用以下公式(式12)式12中,CLint,TS是指由于肾小管分泌引起的内在清除率,而TSchild和TSadult分别代表儿童和成人的肾小管分泌率。
得到肾小球滤过以及肾小管排泄的固有清除率之后,便可以预测药物在儿童肾脏中的清除率,方法类似于药物肝脏清除率的预测。
综上,PBPK建模可以通过数学的手段去描述和预测儿童个体发育的情况,通过现有的数据支撑,学习和总结个体发育的规律,从而更准确地进行儿童体内来扩展PBPK模型,使预测结果更为准确[32]:药代动力学的模拟仿真。
儿童PBPK模型的建立主要是基于成人PBPK模型的外推,所以与年龄相关的未知参数,比如酶、转运体的表达等,都是决定模型预测能力的关键因素。
例如一些转运体的个体发育规律,目前无法从实验或临床数据中去获取。
这种情况下,应该对这种个体发育的不确定性进行额外的参数敏感性分析,从而对模型进行优化。
通过一个“Predict-Learn-Confirm”的循环建模策略[33],来完善建立的模型,获得更好的预测结果。
3
PBPK建模在儿科药物研发中的应用
儿童的药物治疗仍然是经验主义主导的,目前很少有专门用于儿童的药物说明书,在大部分情况下都是根据医生经验开处方和确定剂量。
据统计,儿童用药中超说明书用药的情况高达60%,这一现象在新生儿中更为严重,90%的新生儿药物治疗都是超说明书用药[34, 35]。
超说明书用药的风险不仅仅是剂量过量而导致的药物不良反应,也包括了由于剂量不足而导致疗效不佳。
在儿科药物开发试验失败的原因中,未能达到安全有效的剂量是主要需要关注的问题。
确定安全有效的剂量一直是儿科药物治疗的一个重要挑战[36]。
近来,PBPK建模作为一种确定最佳儿童用药剂量的先进手段已被用于儿科药物研发中。
随着对个体发育规律的了解,越来越多与儿童年龄相关的参数纳入模型,帮助儿童PBPK模型准确预测药物在儿童体内的药代动力学[10, 11]。
目前,PBPK模型辅助儿科药物治疗研究是当前儿童用药研究的一大热点,因此本综述选取当前几个成功应用儿童PBPK模型的案例,简述儿童PBPK模型在儿科药物研究中的实际应用。
3.1 从成人到儿童血药浓度的预测实例—尼洛替尼的给药方案确定
儿童治疗中的一大难点,就是儿童给药方案的确定。
成人的推荐剂量难以直接应用到儿童身上,所以确定药物在儿童人群中的剂量,是儿童临床个体化治疗的首要问题。
尼罗替尼(Tasigna®)是一种激酶抑制剂,适用于治疗患有费城染色体阳性慢性粒细胞白血病(Ph+CML)的成人以及年龄大于或等于1岁的儿童患者。
在大于或等于1岁的儿童患者,尼罗替尼也适用于对先前酪氨酸激酶抑制剂治疗具有耐药性或不耐受性的Ph+CML[37]。
Heimbach等[38]通过PBPK模型,预测剂量为230mg∙m-2的尼洛替尼在2~6岁儿童患者体内的暴露量。
预测结果显示该给药方案在2~6岁儿童中的暴露量与6~18岁儿童及成人中的暴露量相差不多,成功通过PBPK模型将230 mg∙m-2的体表面积标准化给药方案的适用范围外推至2~6岁的儿童人群。
3.2 利用PBPK模型预测儿童体内的药物相互作用实例—探索CYP2C19在婴幼儿体内的发育与抑制
PBPK模型不仅仅是用于预测药物的药代动力学特征的工具,它还具有发现一些新机制的潜力。
CYP2C19是一种重要的药物代谢酶, 尽管CYP2C19在药物代谢中具有重要作用,但在整个产前期CYP2C19表达只有成人的15%,而新生儿出生后5个月,CYP2C19的表达则呈线性增加[39]。
Duan等[40]建立了CYPC19探针底物泮托拉唑和埃索美拉唑的PBPK模型,在儿童患者中使用这两种探针底物来帮助了解CYP2C19的发育和抑制的机制。
首先两种药物都是CYP2C19的底物,但埃索美拉唑同时也是CYP2C19的抑制剂,也就是说埃索美拉唑存在着自身的抑制,相反泮托拉唑则不存在自身抑制。
根据他们研究的结果,PBPK模型可以很好地预测各个年龄段人群中泮托拉唑的清除率。
然而在考虑埃索美拉唑存在自身抑制的情况下,在新生儿以及婴儿人群中,PBPK模型预测的埃索美拉唑的清除率明显低于实测值。
而预测得到的埃索美拉唑在大龄儿童以及成人体内的清除率则与实测值相吻合。
作者提出,在新生儿阶段有着某种补偿机制,以克服埃索美拉唑的自身抑制,所以预测得到的清除率会显著低于实测值。
当修改埃索美拉唑的模型,删除自身抑制的影响,模型预测的埃索美拉唑在新生儿及婴儿中的清除率反而大大提升。
由此作者认为,这也可以支持他们作出的假设,即在婴幼儿体内存在某种补偿机制,去克服CYP2C19的抑制[15]。
本案例中,模型模拟的结果与实验得到的数据存在差异,通过假设新机制的存在去解释这种差异产生的原因,再通过改变模型的结构对假设加以验证,这也为药物的机制研究提供了一种新的思路。
3.3 用PBPK模型预测儿童的组织浓度实例—儿童脑脊液(cerebrospinal fluid,CSF)中药物浓度预测
以上两个案例主要介绍的是PBPK模型在预测血药浓度方面的作用,但是除了预测血药浓度,PBPK模型同样也可以用于组织浓度的预测,比如脑脊液中的浓度[41]。
脑脊液中的药物处置同样也受年龄相关的变化影响。
不仅如此,脑脊液中的药物浓度还受到影响血脑屏障完整性的脑部疾病的影响,如脑膜炎。
对于某些脑部疾病,药物在CSF中的浓度相比血药浓度是更好的指标。
但对于儿童而言,药物组织浓度的测定难度大,难以获得CSF中的药物浓度,从而限制了临床个体化治疗。
通过PBPK模型,可以预测药物在儿童CSF中的浓度,从而辅助临床治疗。
Laurens等[42]开发了一种通用的儿童脑组织PBPK模型来预测脑内药物的CSF浓度。
该模型通过抗生素美罗培南的血脑屏障渗透优化了脑膜炎小儿患者的血脑屏障渗透性,利用镇痛药对乙酰氨基酚、布洛芬、氟比洛芬和萘普生在小儿脑膜炎患者(3个月~15岁)中的CSF浓度进行了验证。
该模型还能预测新生儿(小于3个月)患其他疾病(如脓毒症)时,脑内药物CSF的变化。
3.4 利用PBPK模型辅助临床试验开展—莫西沙星在儿童临床试验中的首剂量确定
儿科药物开发受到儿童临床试验的限制,导致药物开发难度大,程序复杂。
PBPK建模作为目前儿童药物研究中的热点,可以帮助实验者确定儿童临床试验中的首剂量[43]和临床试验设计等[10]。
Becker等[44]通过建立莫西沙星PBPK模型,完成了在儿童临床试验中莫西沙星首剂量的确定。
首先验证莫西沙星在成人中的PBPK模型,然后将该模型外推至不同年龄段的儿童人群中,通过改变剂量使得儿童人群中莫西沙星的暴露量与成人相近。
结果显示新生儿以及学龄前儿童的首剂量应该调整为成人推荐剂量(5 mg∙kg-1)的1.25~1.8倍之间,从而获得最接近于成人体内的暴露量。
通过PBPK建模,简化了首剂量确定的过程,并且提高了预测的准确性以及安全性,为后续临床试验的开展打下良好的基础。
4
儿童生理药代动力学模型的局限性与挑战
PBPK建模技术在儿童药物研发和监管审查中受到高度推荐,但其理论发展和实际应用仍存在一些局限性。
首先,PBPK模型的发展在很大程度上取决于假定的生理/药理过程及其数学描述的可信度。
这意味着PBPK模型的结果是一系列模拟过程的整合结果,例如蛋白质结合、组织分配、人体组成、血流速率和代谢组织中的酶促反应。
每个过程的模拟是对现实复杂过程的抽象,因此与真实情况可能还会存在一定误差。
这一系列误差会不断累积和放大,最终导致预测结果较实测值相比产生较大偏差。
其次,主要的PBPK建模软件包通常利用已发布或内部验证的公式来构建模型。
虽然可以应用敏感性分析来检查每个参数的影响,但尚未对这些参数的可变范围进行规定。
最终用户要么假设未知参数具有某种可变性[45],要么直接基于临床结果调整参数,以达到PBPK模型预测和临床数据之间更好的一致性[46]。
但这些假设或调整都没有通过实验或理论验证,造成了很大的不确定性。
因此,需要更多的理论和实验开发来进一步验证特定群体中的相关生理参数变异性,使PBPK模型的模拟结果有更好的预测能力。
最后,PBPK建模的最终目标是简化临床试验,并帮助设计相应的试验方案,支持监管决策,加速药物研发过程及临床儿童合理用药,但仍需要临床数据对模型进行一定程度的验证。
而由于缺乏儿童的临床数据,PBPK模型的应用受到了很大的限制。
为了应对这一挑战,需要对儿童生理学有更深入和更广泛的理解,才能完善模型的机制。
并在此基础上,建立起相应的儿童PBPK验证标准,更好地利用PBPK模拟助力儿科用药的开发及临床儿童合理用药。












