肥大细胞(MC)发育分类及功能

肥大细胞最早在5亿年前在海鞘中进化,提供宿主对细菌和寄生虫的天然免疫。几千年来,MC获得了调节炎症、伤口愈合、凝血、适应性免疫和急性过敏反应的其他功能。
造血干细胞(HSC)经过多个阶段分化为肥大细胞。
肥大细胞发育
骨髓分化阶段(多能祖细胞[MMP]、普通髓系祖细胞[CMP]、粒细胞/单核细胞祖细胞[GMP],嗜碱性粒细胞/肥大细胞祖细胞[BMCP]),然后产生肥大细胞祖细胞(MCP)。MCP扩散进入血流,进而进入组织,在那里它们进一步分化为成熟的非增殖颗粒阳性肥大细胞(MC)。
MC是非增殖长期存活定居的免疫组织细胞,它们与普通髓细胞前体(CMPS)不同。
未成熟MC前体(MCP)具有增殖潜能,离开骨髓,通过整合素和趋化因子受体的介导,归巢到皮肤,呼吸道,肠道等上皮组织。
活化后,MCs通过磷脂膜代谢(血小板活化因子、白三烯、前列腺素)、细胞因子(TNF-α、IL-4)和趋化因子(IL-8、单核细胞趋化蛋白1[MCP-1])释放炎症介质(组胺、糜蛋白酶、羧肽酶等丝氨酸相关蛋白酶)。
肥大细胞分类及功能
成熟的人MC被典型地划分为两个亚群。MCTC表达类胰蛋白酶、糜蛋白酶、碳基肽酶和组织蛋白酶,在结缔组织中和皮肤占优势。
MCT表达类胰蛋白酶但没有其它丝氨酸蛋白酶,在健康肺实质和肠道粘膜中占主导地位。炎性细胞因子如IL-4可改变MCT和MCTC在肺中的平衡,导致哮喘患者中的MCTC占优势。MC亚型之间的相互转换取,决于微环境微环境。
MC两个亚群,在功能和临床上具有不同的意义,MCT通过表面Fc的交联而激活(RI导致经典IgE介导的超敏反应)。相比之下,MCTC高水平表达Mas相关的G蛋白偶联受体X2(MRGPRX 2),该受体通过磷脂酶C途径激活细胞质钙释放。
MRGPRX2可被P物质、过敏毒素C3a、C5a、VIP等内源性肽以及吗啡、万古霉素、磺胺甲恶唑、西沙曲库铵等药物激活。
MRGPRX2在MCTC上的激活,诱导了一个快速但更少颗粒释放的类过敏反应。MRGPRX2活化在慢性自发荨麻疹中也是重要的。释放的胃促胰酶直接从MCTC释放,将血管紧张素I转换为血管紧张素II,可能有助于血管哮喘、动脉粥样硬化和主动脉瘤的重塑
肥大细胞调节免疫
肥大细胞(Mast Cell)主要释放三类因子:激活(Activation)、抑制(Inhibition)、迁移(Migration).
在适应性免疫反应(如由寄生虫、动物毒液或过敏原引起的)中,IgE与双价或者多价抗原交联,并与MC细胞表面FcεRI受体结合的,或当免疫复合物(IgG-ICs)与FcγRs结合时,MCs可被激活。
在某些情况下,例如在小鼠BMCMS中,FcεRI与抑制性FcγRIIb联合作用可以下调MC的激活。在抗体/抗原介导的刺激下,MCs可以合成和分泌一组因子(炎症因子:TNF-α,IFN-γ,IL-1,4,5,6,9,11,13;调节细胞因子:IL-10,TGF-β,IL-2,生长因子:IL-3,6,9,SCF,GM-CSF;促细胞分裂素:FGF-2,VEGF;趋化因子:CCL1,2,3,4,7,8,9,17,20,22,CXCL2,8;颗粒相关细胞因子:TNF,NGF,VEGF,TGF-β,PDGF,SCF,FGF2)。
反过来,这些因素可以影响其他免疫和非免疫(结构)细胞,并导致各种类型的过敏反应,可能是自身免疫性疾病,如某些形式的关节炎,以及宿主防御毒液或寄生虫。这些免疫和结构细胞由功能上不同的亚型(例如,T细胞、DC、巨噬细胞、成纤维细胞、神经)组成,并且特定MC产物对这些细胞的影响可能因靶细胞亚型而显著变化。MC衍生的产物也可能通过对结构细胞的影响,和通过调节炎症/免疫反应的各个方面来促进组织的修复和重塑。
抗体/抗原介导的刺激还能诱导MCs分泌预先形成的介质,如组胺、血清素(主要是啮齿类动物)、蛋白多糖和蛋白酶,以及某些细胞因子和生长因子,这些细胞因子和生长因子可能与颗粒有关,以及许多脂质介质,包括半胱氨酸白三烯和某些前列腺素。
IL-33是由组织损伤部位的内皮/上皮细胞产生的,它能刺激MCs分泌多种因子(IL-4,5,6,13,TNF,CCL1,2,3,17,22,IL-10,GM-CSF),对其他免疫细胞和非免疫细胞有不同的潜在影响,可能有助于过敏的发病和宿主防御。
病原体的产物,如脂多糖和肽聚糖、多聚(I:C)和某些病毒可以通过TLR(Toll样受体)直接激活MCs,导致多种因素的分泌(IL-1,,4,5,6,12,13,TNF,VEGF,GM-CSF,IL-10,CCL2,4,8,20,CXCL2,8,10);这可能有助于宿主防御和/或疾病(例如,某些病毒感染和哮喘恶化之间有很好的临床联系)。
在Th2细胞样免疫应答,IL-4或IL-9来自T细胞或MC谱系中的未成熟细胞,可激活MC促进其发育并增殖。
特定趋化因子诱导MC迁移,同时也可以活化MC。
IL-3,SCF (干细胞因子)是支持MC发育的因子的代表,增殖和/或存活(其它因子IL-4,IL-6,IL-9,和NGF)。IL-3对嗜碱性粒细胞有类似的影响。
神经生长因子、VEGF(血管内皮生长因子)、FGFs(成纤维细胞生长因子)和TGF-11可以促进纤维化或血管生成的发展。如TNF(肿瘤坏死因子)可组成地储存在一些MC的颗粒中,这些因子也可以影响MC。P物质是某些神经元的产物,能有效地激活某些类型的MC,而MC又能分泌预先形成的介质,其中可能包括颗粒相关的细胞因子(TNF,NGF,VEGF,TGF-β,PDGF,SCF,FGF2)。
某些神经细胞和MC之间的双向相互作用已经得到了广泛的研究,这种神经-MC相互作用在健康和疾病中的潜在重要性引起了广泛的关注。
从活化的MC释放的蛋白酶可以降解TNF、IL-1、IL-18、IL-33、SCF、CCL5和CCL11、CCL26,以及图中可能显示的其他因素,这些可能是MC可以控制的一个重要机制。
这些因素决定生物效应的强度和持续时间。
肥大细胞的细胞网络
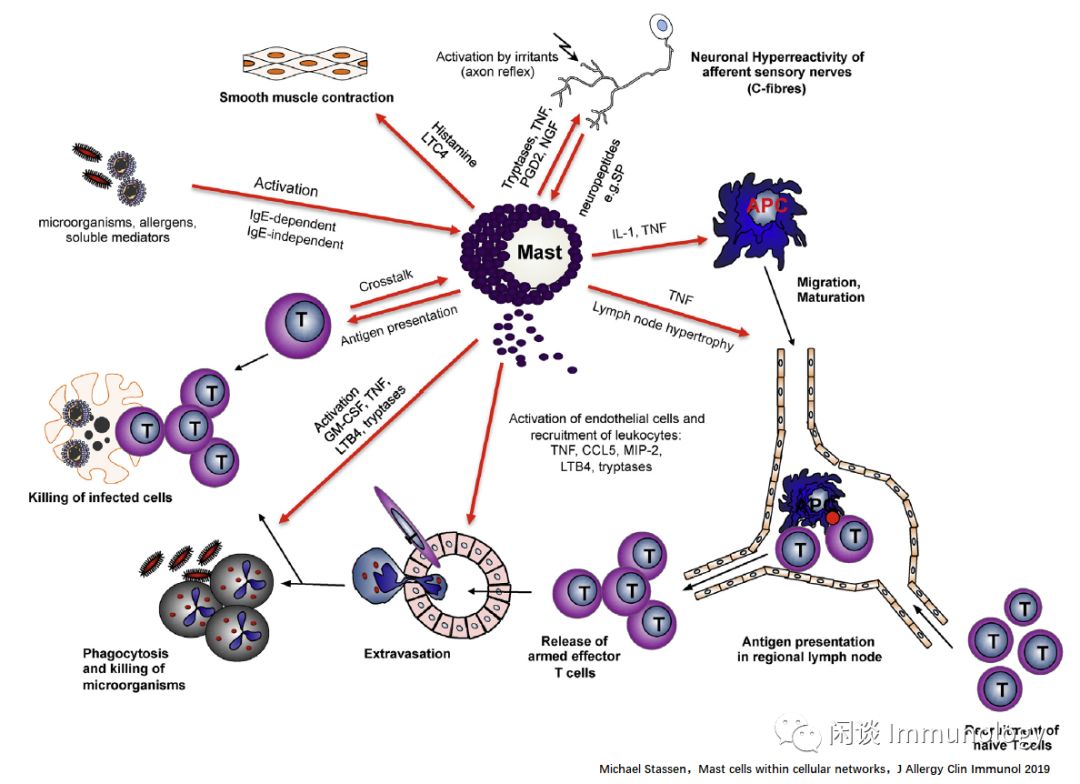
肥大细胞与APC细胞,中性粒细胞,效应T细胞等免疫细胞相互调节,也与内皮细胞,神经元等相互作用。
传入感觉神经元(C-纤维)可通过外源激活或内源性刺激而激活, 这建立了导致神经源性炎症的轴突反射机制。 分泌的通过轴突反射机制释放的诸如SP的神经肽通过结合激活肥大细胞,NK受体或MRGPRX2释放炎性介质(组胺和白三烯C4),促进平滑肌细胞收缩。 反之,肥大细胞衍生介质(类胰蛋白酶、组胺、半胱氨酸、白三烯和神经营养素)激活传入神经元会导致神经元高反应性,从而形成神经炎症的恶性循环。
由IgE或IgE独立信号激活的肥大细胞能够促进含有抗原的专业APCs向引流淋巴结的迁移,在该淋巴结处它们开始抗原特异性T细胞的扩增。
肥大细胞介质,如CCL5/RANTES,对招募 CD8+T细胞 到病毒感染部位起着重要作用。
效应T细胞和肥大细胞的活化也可以由细胞间相互作用触发。 在这种情况下,肥大细胞可以作为非专业的APC发挥作用。
此外,肥大细胞能够激活内皮细胞,吸引中性粒细胞,作为许多急性炎症反应的关键事件。此外,肥大细胞也能促进中性粒细胞的活化。
喵评: 肥大细胞通过释放一系列调节因子,如细胞因子、趋化因子等,调节T细胞,中性粒细胞、APC等免疫细胞,以及内皮细胞,神经元等,参与抗感染免疫,过敏,自身免疫性疾病等。
参考文献
Amy Wilcock,Mast cell disorders: From infancy to maturity,Allergy. 2019;74:53–63.
Kaori Mukai,Mast cells as sources of cytokines, chemokines, and growth factors,Immunological Reviews. 2018;282:121–150.
Michael Stassen,Mast cells within cellular networks,J Allergy Clin Immunol 2019