作者丨 孟凡康
来源丨 再创丨Regenesis(ID:Bio-Regenesis)
原标题丨再创丨2019年合成生物学年度进展回顾
合成生物学作为生命科学和生物技术领域的发展新方向代表之一,充满着无限的发展活力。2019年合成生物学领域有很多重大的成果,这代表着我们对于生物的工程化改造和设计能力的进一步增强。我将按照(1)基因(组)编辑、合成和组装;(2)元件开发与基因线路设计;(3)宿主和生物群系工程;(4)数据集成、建模和自动化;这四个发展方向对合成生物学2019年的发展进行总结。
(这篇文章仅代表个人观点,如有遗漏或者错误,还请批评指正。所选工作并没有任何偏好性。)
总体来说:
1. 我们对于基因组的工程改造能力进一步增强
2. 开发出了更加丰富、功能强大的调控元件或者工具
3. 理性设计的能力进一步增强,包括蛋白质设计、基因线路设计
4. 遗传改造生物的应用前景更加丰富多样
5. 越来越多的工作在聚焦两点:1.理性设计 + 定向进化;2.大数据分析 → 理性设计;
1
基因(组)编辑、合成和组装领域
1. 开发更加精准、高效的的基因编辑工具
麻省理工学院和哈佛大学博德分校的David Liu团队开发了一种新的CRISPR基因组编辑方法,相关文章发表在《自然》 [1] : 新方法将分子生物学中两个最重要的蛋白质—— CRISPR-Cas9和逆转录酶——整合到一起。该系统称为"Prime Editing" ,其能够以精确、高效和高度通用的方式直接编辑人体细胞,可以有效地进行四种类型的单碱基置换:C到T,T到C,A到G和G到A。该方法扩大了生物学和治疗学研究的基因编辑范围,解决了传统单碱基编辑工具的弊端,并有可能纠正多达89%的已知致病基因变异。这行工作是精准基因编辑领域的重大突破,在单碱基随意转换和小片段多碱基的增删方面潜力巨大,这将极大的推动生物医学的基础研究和临床基因治疗研究。
《自然》: Search-and-replace genome editing without double-strand breaks or donor DNA
2. 利用基因编辑工具治疗重大遗传病
来自中国北京大学的邓宏魁研究团队在《新英格兰医学杂志》发文[2],其利用 CRISPR技术编辑干细胞治愈艾滋病毒和急性淋巴细胞白血病患者治疗领域取得关键进展 。研究将CRISPR编辑后的CCR5缺失造血干细胞和祖细胞(HSPCs)移植到HIV-1感染和急性淋巴细胞白血病患者体内。携带缺失CCR5的供体细胞持续19个月以上,且无基因编辑相关不良事件,急性淋巴细胞白血病完全缓解。
《新英格兰医学杂志》:CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia
3. 基因组的合成和改造能力进一步增强
[3],该团队人工合成并替换了全部的4Mb大肠杆菌基因组,并将其中丝氨酸的密码子TCG和TCA替换为同义密码子AGC、AGT,琥珀密码子TAG替换为TAA,成功构建一株只有61个密码子的大肠杆菌,从而为重编码多种非标准氨基酸奠定了基础。
《自然》:Total synthesis of Escherichia coli with a recoded genome
同样来自此研究组,《科学》报道了其利用基因组工程改造技术将细菌的基因组改成为任意不同大小的环化基因组对,同时通过基因组融合技术,将来自不同菌株的基因组区域组装成一个单一的基因组 [4] 。 这为精确、快速、大规模(兆碱基)的创建各种合成基因组的操作提供了关键的技术支持。
《科学》:Programmed chromosome fission and fusion enable precise large-scale genome rearrangement and assembly
来自美国的Ben Black研究团队则设计一种可以绕开着丝粒DNA序列的人类人工染色体 [5] ,此种人工染色体无需大阵列的着丝粒α-卫星重复序列,从而能够为人工基因组设计带来极大的便利,移除了哺乳动物合成基因组的关键阻碍。相关文章发表在《细胞》。
人类基因组编写计划(Human Genome Project-Write)是由多位学者发起的全球合作项目,旨在通过对人类基因组进行从头合成编码,在10年之内将大基因组(大到1000亿对碱基)的改造和测序成本再降低1000倍,并最终解决人类面临的重大健康问题如满足人体器官移植日益增长的需求;通过基因组水平的基因改造技术,创造出抵抗所有病毒的细胞株;创造能够抵抗癌症的细胞株系;利用人体细胞或者类器官高效的生产疫苗和药物等等。 在2019年,人类基因组编写计划项目得到了进一步的推动, 多位学者在《科学》 [6] 联合发文倡导进行全球协作 ,共同攻克合成基因组中的难题,最终通过编写和测试完整的基因组,充分释放工程生物学的全部潜力。
2
元件开发与基因线路设计
1. 开发多种优质调控工具和传感器工具
来自英国帝国理工学院的Tom Ellis研究组在《细胞》发表工作 [7],通过对于酵母基因组的GPCR信号感应系统进行工程化改造,可以使酵母作为高灵敏、价格低廉的生物传感器用于疾病、感染因子和药物分子的监测和响应。
《细胞》:Engineering a Model Cell for Rational Tuning of GPCR Signaling
[8],该研究团队设计了一种可通过感受体表感觉来调节治疗性蛋白质的生产的生物开关,用于治疗糖尿病和肌肉萎缩症;
来自中国华东师范大学的叶海峰研究团队在《科学 · 转化医学》 [9]发表可以响应绿茶成分的开关 : 当人体植入某种定制化细胞后,人们只需通过饮用特制的浓缩绿茶,便可使其在体内产生代谢物原儿茶酸进而控制细胞中目的基因的表达。 而这种目的基因可按照需求调整改变,可以变为提高人体免疫力的抗体,也变为清除体内有害分子的酶,还可以变为降低血糖的胰岛素;
,其灵敏度和便捷实用程度得到了进一步的优化和提升,相关工作发表在《自然 · 生物化学》[10];
来自加州理工学院的Mikhail G. Shapiro研究团队则设计了哺乳动物细胞中基因表达的超声成像系统。相关工作发表在《科学》[11]。 为了将超声造影剂与哺乳动物细胞中的基因表达联系起来,研究团队在细胞内引入了经过改造的声波报告系统。哺乳动物的声学报告基因可以使细胞以低于0.5%的体积密度可视化,并可以对活体动物中的基因表达进行高分辨率成像。
《科学》:Ultrasound imaging of gene expression in mammalian cells
来自斯坦福大学的Michael Z. Lin研究团队开发了一种名为RASER的技术用于癌症治疗:重编程异变信号,使其成为效应因子。相关文章发表在《科学》上 [12]。研究团队利用合成生物学方法构建了一个可以响应这些癌症激活信号的通路(蛋白质基因线路—蛋白酶+磷酸化结合位点+下游信号拓展)。只要细胞发生癌变,这个合成的信号通路就会被激活从而在下游表达一些效应因子。而这些效应因子可以做很多事情,比如利用dCas9调控癌症细胞基因的表达或者激活细胞自噬的过程,从而导致癌症细胞的凋亡。
《科学》:A compact synthetic pathway rewires cancer signaling to therapeutic effector release
同时来自芝加哥大学的Bryan C. Dickinson团队则开发了一种CRISPR-Cas启发的RNA靶向系统(CIRTS),一种可用于构建可编程RNA控制元件的蛋白质工程策略。 CIRTS提供了一个调控RNA的平台,同时CIRTS的人源性避免了人体免疫攻击的潜在问题。相关工作发表在《细胞》[13]。
,该研究利用了原核生物中σ54因子的一种特殊“闭锁技能”,实现了高质量的CRISPR激活调控。相关工作发表在《自然·通讯》上[14]。
2. 利用蛋白质设计开发全新蛋白质功能,取得关键突破
2019年来自美国的David Baker研究团队同时《自然》发表文章,介绍其从头设计自然界不存在的生物活性蛋白质开关LOCKR [15]和生物反馈网络degronLOCK[16]。研究人员选择了能够在广泛动态范围内调整“笼子-门闩”和“笼子-钥匙”相互作用的密切关系的结构特征——螺旋结构,从头设计出开关蛋白质LOCKR的结构系统,可在体内降解目标蛋白,其即插即用特性来实现对内源性信号通路和合成基因电路的反馈控制。这是蛋白从头设计领域的又一里程碑,为合成生物学提供了全新的调控工具。
《自然》:De novo design of bioactive protein switches
来自加州大学的Tanja Kortemme团队则进一步利用蛋白质计算设计工具设计了模块化蛋白质感应系统[17]。这篇《科学》文章描述了从头建立到异二聚体蛋白质-蛋白质界面的结合位点以及将配体与分裂蛋白响应相偶联的通用计算策略。此种设计策略可以实现任意的蛋白质传感器设计,为生物输出与新信号的连接开辟了广阔的渠道。
《科学》:Computational design of a modular protein sense-response system
3. 合成生物学领域在计复杂基因线路的能力进一步增强
2019年来自MIT的James Collins团队在《科学》发表工作 [18],该团队使用人工设计的真核系统协同调控组件在合成基因电路中进行复杂信号处理,该工作显着扩展了可用的工程设计思路,进一步提升了人类对于真核系统的调控能力。
《科学》:Complex signal processing in synthetic gene circuits using cooperative regulatory assemblies
同样来自MIT的Michael Laub和Chris Voigt合作团队在《自然》发文 [19],文章设计了与大肠杆菌本身完全正交的双组分信号传导网络,并指出旁系同源物的序列空间具有相对稀疏性,新的正交途径在进化过程中很容易出现或者可以完全从头设计。
《科学》:Engineering orthogonal signalling pathways reveals the sparse occupancy of sequence space
来自苏黎世联邦理工学院的Mustafa Khammash研究团队则设计了一种可以实现完美自适应的生物分子积分反馈控制器。相关文章发表在《自然》上 [20]。其工作用数学方法证明,存在一个基本的生物分子控制器拓扑可实现积分反馈并在具有噪声的任意细胞内网络中实现鲁棒的完美自适应。在此概念的基础上,他们对细胞中展示了此种网络的可调谐性和适应性。
《自然》:A universal biomolecular integral feedback controller for robust perfect adaptation
3
宿主和生物群系工程
1. 设计非天然生物系统,扩展生命的可能性
[21],研究人员人工开发了两对新的核苷酸碱基对,分别是S:B和Z:P。这两种新的碱基对均以氢键形式配对,具有储存遗传信息、满足达尔文进化需求、满足遗传信息传递的能力。这项工作将原本人体内的4种核酸碱基拓展到了8种核酸碱基,进一步丰富了生命的遗传信息,拓展了生命进化方向以及宇宙中生命存在的可能性。
《科学》:Hachimoji DNA and RNA: A genetic system with eight building blocks
来自德国的Edward Lemke设计了一种人造无膜细胞器,其可以在哺乳动物细胞中进行正交翻译 [22]。研究团队通过相分离和空间靶向的方法,通过募集RNA靶向系统、终止密码子抑制系统和核糖体,创造了仅翻译特定类型的mRNA的无膜细胞器。这是一种简单而有效的人工细胞器生成方法,为半合成真核细胞中的定制正交翻译和蛋白质工程提供了一条新的途径。相关工作发表在《科学》上。
《科学》:Designer membraneless organelles enable codon reassignment of selected mRNAs in eukaryotes
2. 利用宿主进行天然或者非天然物质的按需生产
[23]。研究人员对酿酒酵母自身的代谢途径甲羟戊酸途径进行了改造,并引入合成己酰辅酶A的代谢途径。同时利用生物信息学的方法,挖掘了数种植物的转录组或基因组,从不同的生物中中寻找基因元件,引入及改造超过15个来自不同物种的基因,在酵母中实现了人工设计和改造的代谢通路,合成了大麻素复合物种主要的化学分子,包括:大麻萜酚酸(CBGA)、四氢大麻酚(THCA)、大麻二酚(CBDA)。同时这一平台可以进一步用于合成更多的大麻类化学衍生物。这项工作为未来更广泛的关于大麻素的相关研究提供了方便,有望促进针对多种人类疾病的新药研发。
《自然》:Complete biosynthesis of cannabinoids and their unnatural analogues in yeast
来自美国伊利诺伊大学香槟分校的Wilfred A. van der Donk研究团队在《科学》发表研究 [24],阐述了一种特殊的天然产物合成方式: 核糖体合成的小肽充当非核糖体肽延伸和化学修饰的支架,氨基酸则通过这种骨架转移到肽的羧基末端,而这种化学反应与核糖体无关。 这些结果为氨基酸衍生的天然产物的生物合成提供了另一种范式,同时相关基因簇的发现表明该种策略可能广泛存在以自然界。
2019年来自华东理工大学张立新等研究团队在《自然·生物技术》发表文章 [25],70年来首次在代谢水平上清晰阐明链霉菌初级代谢到次级代谢的代谢转换机制并进行工程应用。研究揭示了链霉菌胞内三酰甘油降解和聚酮类药物合成的代谢机制,为实现聚酮类药物乃至其他次级代谢生物活性产物高效、绿色、智能的生物制造开辟了新思路。
3. 改造和设计宿主解决人类社会挑战
[26],其利用合成生物学手段在转基因烟草植物中构建了一种新的代谢途径,其可以更有效地重新捕获光合作用的副产物,同时减少植物的能量损耗。 在田间试验中,这些转基因烟草植物的生产力比野生型烟草植物高约40%。
《科学》:Synthetic glycolate metabolism pathways stimulate crop growth and productivity in the field
来自哥伦比亚大学的Tal Danino研究团队在《自然 · 医学》发文 [27],其通过对细菌进行编程,可使其表达CD47抗肿瘤蛋白,可以诱导持久的肿瘤消退和全身性抗肿瘤免疫,对患者癌症有极大的改善。
来自MIT的Tim Lu研究团队在《细胞》发表成果 [28],其通过定向进化和结构建模对细菌体的用于识别宿主的尾部结构进行工程改造。随之产生的突变库可以有效的应对细菌产生的噬菌体抗性,这项工作在减缓耐药性产生以及噬菌体工程改造上具有重要的参考价值。
2019年合成生物学家通过改在大肠杆菌和酵母,使得异源生长的生物完全成为自养型生物。 [29]报道了他们首次通过合成生物学改造和实验室进化构建出仅利用CO2作为唯一碳源的自养型大肠杆菌的研究成果。研究通过通过简单的理性设计,最后利用实验室适应进化了长达400天,最终获得了能够以CO2位碳源的大肠杆菌。
随后来自奥地利的Matthias G. Steiger研究组在《自然·生物技术》发表工作 [30],阐述了将工业菌株巴斯德毕赤酵母从异养型转化为能够在CO2上生长的自养型的系统工作,其在在酵母中将过氧化物酶体甲醇同化途径改造成类似于Calvin–Benson–Bassham循环(主要的天然CO2固定途径)的CO2固定途径,并通过适应性实验室进化,将自养酵母的生长速率进行了优化,此类工作为解决食物、能源与环境问题提供了新的生物方案。
《细胞》:Conversion of Escherichia coli to Generate All Biomass Carbon from CO2
4. 探索合成群系系统的复杂原理,为创造复杂系统建立基础
[31]揭示了生物菌群迁移进化过程中的竞争规律 ,为人造系统设计发的设计提供了全新的指导建议。
《自然》:An evolutionarily stable strategy to colonize spatially extended habitats
同时,来自多国的科研人员在《自然·微生物学综述》上发表综述[32],阐述了工程化改造生物群系的一般原则,为合成生物学设计和探索更复杂生物群体提供了指导和方向。
《自然·微生物学综述》:Common principles and best practices for engineering microbiomes
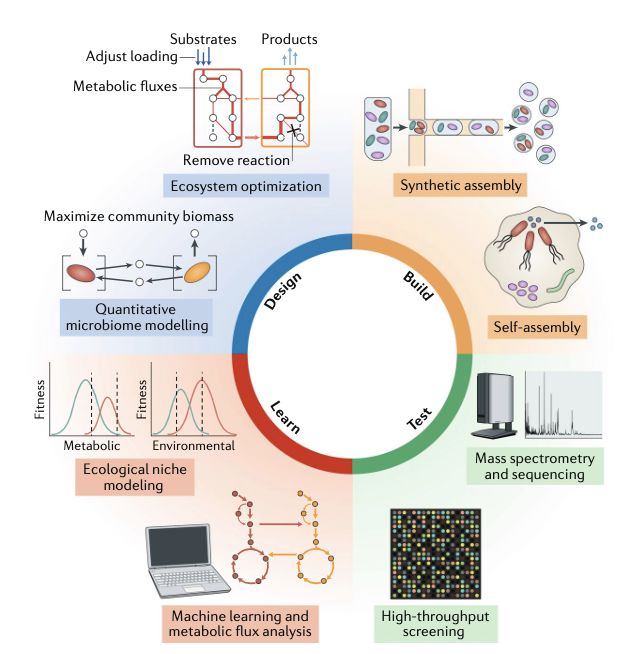
来自UCSD的Jeff Hasty研究团队在《科学》发表工作,其利用工程化的动态种群提高了基因线路的遗传稳定性 [33]。研究人员采用以生态相互作用为指导的互补方法,设计了周期性种群控制来稳定细胞内基因电路,避免潜在突变造成功能的缺失。此系统包含三种大肠杆菌菌株,每种菌株可以杀死或被另外两种菌株之一杀死。由此产生的“剪刀石头布”动力学表现出了微流控设备中菌株的快速循环,并使细胞培养中基因回路功能的稳定性增加。
《科学》:Rock-paper-scissors: Engineered population dynamics increase genetic stability
4
数据集成、建模和自动化
1. 全球合作推动设施共建、标准共享与数据互通
2019年国际合成生物设施联盟(Global Biofoundry Alliance,以下简称“GBA”)在日本神户正式成立。 该联盟由美国劳伦斯伯克利国家实验室、英国帝国理工学院、中国科学院深圳先进技术研究院等来自全球8个国家的16所顶尖合成生物设施机构联合发起[34]。GBA致力于促进全球合成生物学产业发展,加速合成生物学和生物制造工艺工程的商业化,联盟各成员将加强设施间的协作沟通,共享基础设施、开放标准、分享最佳案例、互通数据资源,以在全球推动合成生物设施建设为目标,共同应对可持续发展等全球性科学挑战,进一步推动生物技术的变革。
2. 利用机器学习等AI技术推动合成生物学复杂设计
合成生物学公司Asimov建立了一个全栈平台来对活细胞进行编程,并已获得国防高级研究计划局(DARPA)自动化科学知识提取(ASKE)的一部分的合同 [35]。通过ASKE,Asimov将致力于为生物学开发基于物理的人工智能(AI)设计引擎。该计划的目标是提高对复杂细胞行为进行编程的可靠性。阿西莫夫(Asimov)是一家合成生物学公司,致力于建立一个完整的基因设计平台来对活细胞进行编程,其多学科团队将基因工程,设计自动化和人工智能相结合,以实现分子制造和治疗领域的新应用。
同时利用机器学习辅助合成生物学研究等面取得一定的突破。来自美国的Frances Arnold研究团队在《自然 · 方法》期刊发表综述 [36],阐述了利用机器学习进化蛋白质的方法,其中机器学习可以指导的定向进化进行蛋白质工程,优化蛋白质功能,而无需详细的基础物理或生物学途径模型,这为按需开发优质蛋白质元件提供了全新的思路。
来自Huiming Zhao研究组开发了全自动化算法用于合成代谢系统的改造和设计,相关工作发表在《自然 · 通讯》期刊上 [37],该研究利用集成机器人系统BioAutomata与机器学习算法相互结合,使得生物系统设计的“设计-构建-测试-学习”流程实现完全自动化,并以我们已经通过优化番茄红素的生物合成途径证明了其功能。
来自博德研究所的Aviv Regev研究则在《自然·生物技术》发文,其研究用用1亿个随机启动子破译真核基因调控逻辑 [38]。测量了超过 1亿个完全随机的合成酵母启动子序列的表达输出,并使用机器学习来构建可解释的转录调控模型。
《自然·生物技术》:Deciphering eukaryotic gene-regulatory logic with 100 million random promoters