FDA王亚宁
生理药代动力学PBPK建模
的现状与挑战:法规监管的观点
FDA临床药理办公室OCP王亚宁博士(Yaning Wang)于2019年11月,在FDA举办的“发展PBPK建模的最佳做法,以支持临床药理法规监管的决策”研讨会上做了“生理药代动力学PBPK建模的现状与挑战:法规监管的观点”的报告。
以下为王博士报告的PPT与凡默谷的部分解读。

背景
2019年11月18日,FDA举办了“发展PBPK建模的最佳做法,以支持临床药理法规监管的决策”研讨会,Development of Best Practices in Physiologically Based Pharmacokinetic Modeling to Support Clinical Pharmacology Regulatory Decision-Making。
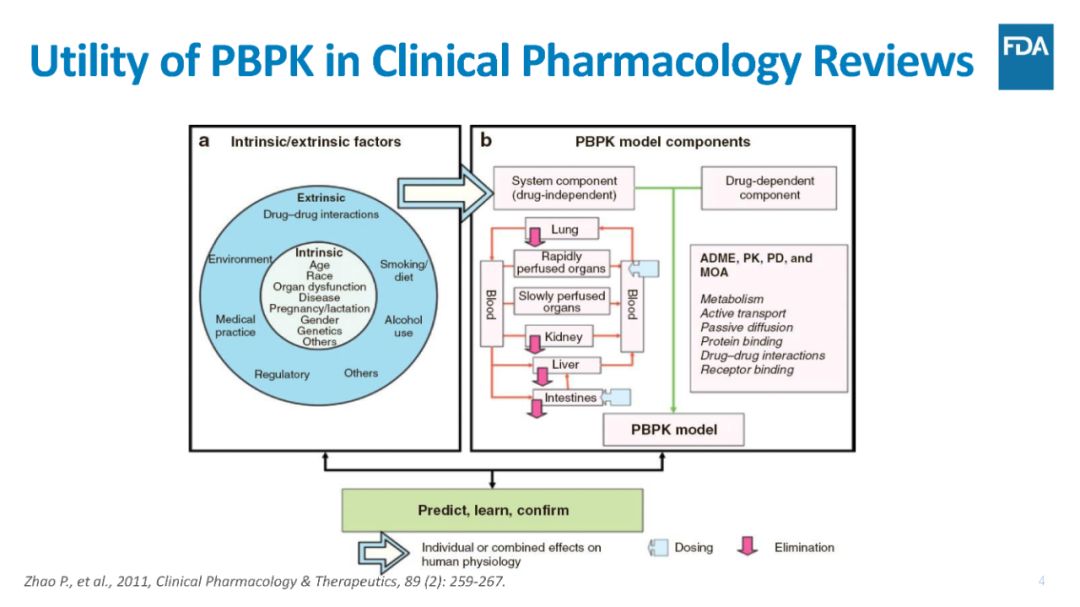
生理药代动力学PBPK模型是促进药物开发的有力工具,通过整合动物和人体的生理学参数,药物的理化性质,药物的临床前和临床信息;从而可预测在研新药IND的吸收,分布,代谢,排泄和药代动力学(PK)。
过去几十年,制药企业和法规部门使用PBPK建模和模拟进行大量的研究,以解决很多临床问题,例如探索药物的外在影响因素和内在因素对药物的体内暴露的影响。外在影响因素指例如联合用药引起的药物相互作用DDI,食物摄入的影响,和内在因素指例如年龄,器官功能障碍,疾病状态,基因多态性等的影响。
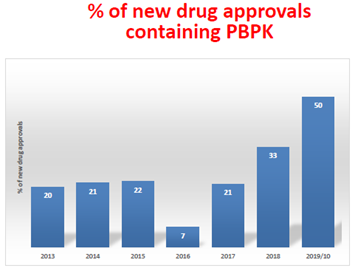
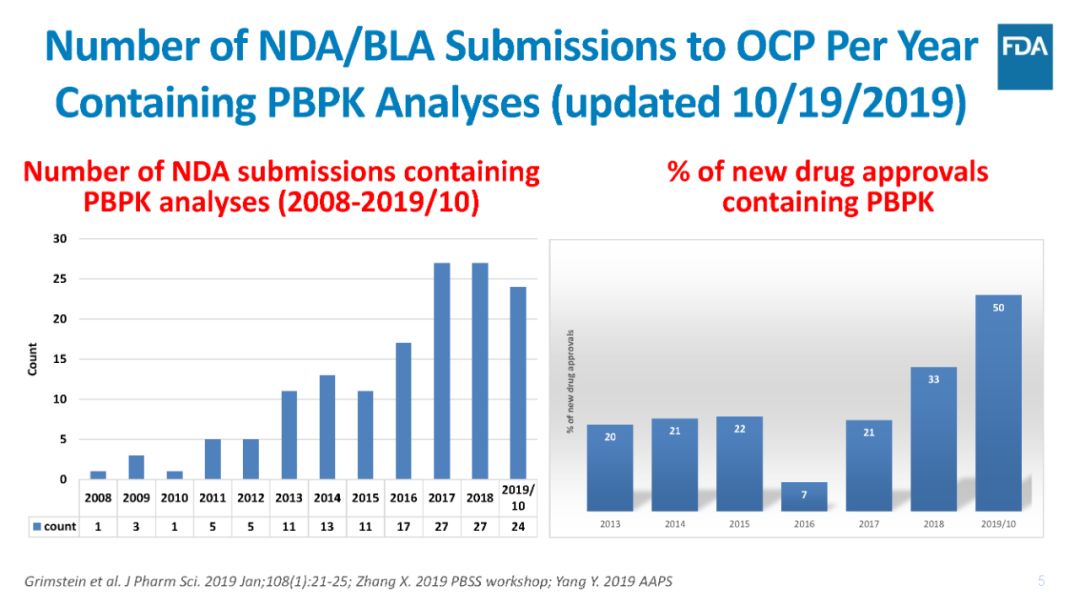
FDA指出,目前提交给FDA的申请资料中大量含有PBPK建模和模拟方法,如2018年NDA申报资料中有33%含有PBPK模型,2019年(截至到2019年10月)NDA申报资料中有50%含有PBPK模型。
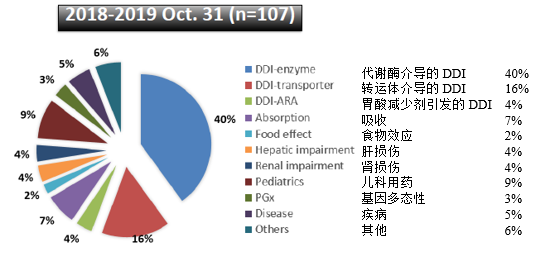
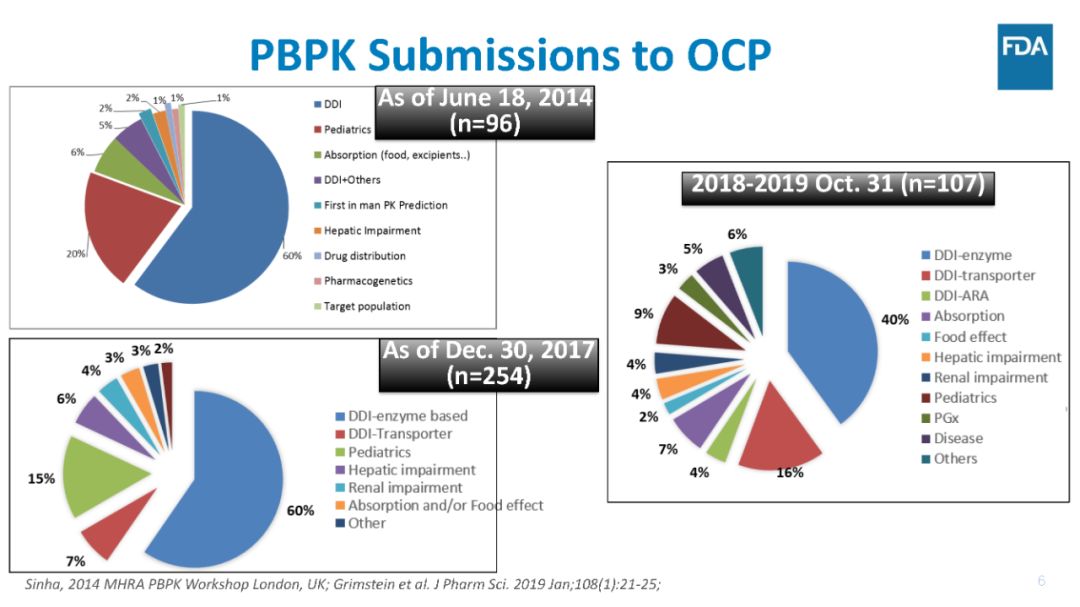
其中,约60%的新药申报材料是用于预测药物相互作用DDI的风险,以支持联合用药时进行剂量调整建议。
但PBPK模型的复杂性和相关知识体系的鸿沟,使PBPK模型无法用于作为特定监管决策的常规工具,本研讨会通过设定PBPK建模与模拟方法当前的局限性,探索PBPK建模与模拟可在何时、在哪个些方面及如何做,从而指导法规监管的决策。
该PBPK研讨会的目标
讨论通过整合体外和体内数据来开发PBPK模型,和制定PBPK模型证据验证标准的“最佳做法”,从而用开发好的PBPK模型指导法规监管决策;
分享应用PBPK建模和模拟的经验和案例,突出PBPK方法的机会和局限性;
从利益相关者那里获取以下想法:可以在何时,在在哪些方面,如何使用PBPK建模和模拟指导监管决策,及有哪些局限性;
讨论在药物开发和监管审评中为促进PBPK建模科学的发展,还存在知识系统的不足,并还需要进行哪些研究?
PPT要点
FDA临床药理办公室OCP已经审评了200多个含有PBPK模型的审评资料,目前新药审评申请资料中含有PBPK模型日益增多,2019年(截至到2019年10月)NDA申报资料中有50%含有PBPK模型。当前,新药申报材料中的PBPK用于预测药物相互作用DDI的风险的最多,达60%,具体应用领域请见下图。
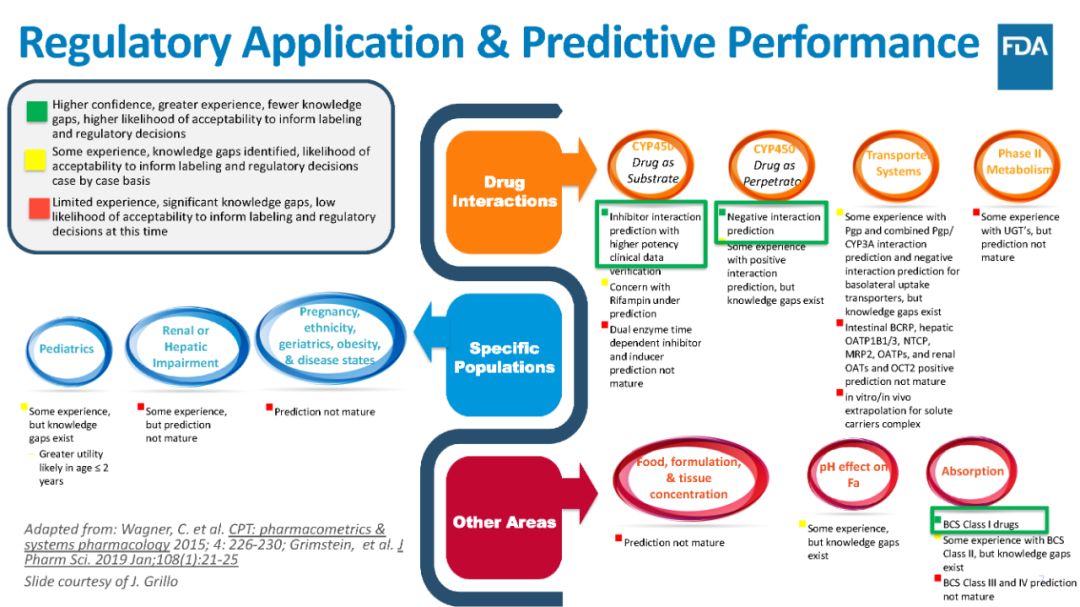
报告还梳理了PBPK模型当前在法规监管中的应用和预测性能。当前预测性能最好的是:1)当IND作为CYP底物时,有高质量的临床PK数据验证,用于预测抑制剂与IND的DDI情况;
2)当IND作为CYP施害药时,预测DDI为阴性结果;
3)采用基于生理的吸收模型预测BCS I类药物的吸收。
此外,列举了FDA和EMA发布的相关指导原则,FDA和学术单位发布的相关文章。
PPT