COVID-19迅速蔓延,已升级为全球公共卫生危机,没有哪个国家可以独善其身,置身事外。短期来看,集体抗疫成为重中之重,而长远来看,医药行业也许再也回不到疫情前的常态。
01
药物供需平衡
COVID-19疫情已经影响到了药物生产,供应和需求。医药公司需尽早就药物生产、原料药采购做出应对决策,以保证正常的生产和供应。截至三月底,欧洲国家并没有报道COVID-19相关的药物紧缺,而美国FDA多次发文强调企业需规划好生产,避免供应短缺。
在原料药和药物生产上,医药行业高度全球化。随着COVID-19蔓延到众多国家,人们不禁担心全球医药供应链的安全性。中国是重要的原料药供应国,为欧美市场提供大量的仿制药。所幸本次疫情并未影响中国的制药行业。中国的制药企业多位于沿海省市,远离本次疫情的中心。同样,印度的仿制药企业,也常常依赖中国的原料药,他们都库存充足。印度从3月3日起临时限制某些药物出口。韩国是生物类似物生产大国,虽受疫情影响,但并未看到药厂关闭(见图1)。
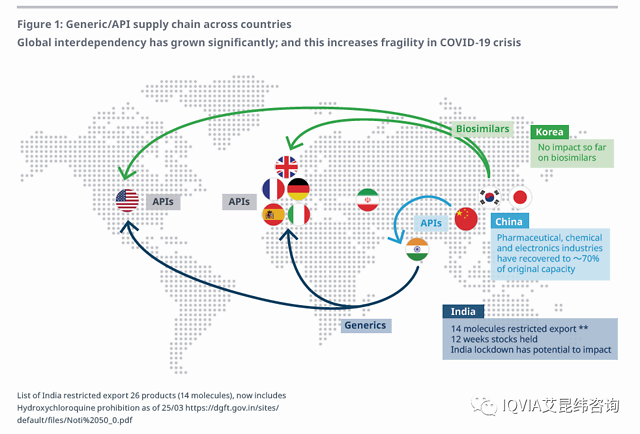
潜在影响将继续存在,但影响将进一步减弱:
•生物类似物影响不明显,大多数韩国药企仍全负荷生产
•中国原料药厂都位于影响较小的省份
•75%印度药企的原料药供应来自中国
•亚洲将更加依赖中国产品的供应
•欧洲库存充足,影响有限
•美国自有原料药生产企业,2019年8月数据显示,13%的美国原料药供应来自中国
关注
02
药物供需平衡
监管机构正面临越来越大的压力,如何在高效审批新药的同时,确保其有效性和安全性。后者还对监管机构提出了新的要求,包括密切监测最新、最准确的新冠药物的相关事项(例如,关于使用布洛芬可能导致新冠肺炎恶化在社交媒体上引起广泛讨论,后被官方辟谣)。
监管机构也在积极采取行动,为受到疫情影响的非新冠药物的相关临床试验提供便利。例如,FDA在3月下旬宣布,放宽对临床试验远程监控设备的应用,帮助那些不能或不愿前往医院的受试患者,从而维持临床试验的正常进行。这一放宽制度暂时限定在新冠疫情期间执行,FDA并不会成为医药公司申请产品新适应症、药用价值的障碍。事实上,FDA已建议尽可能提升临床试验的远程化/网络化,包括远程访视、电话访谈和自我健康管理。长期来看,这可能会成为一种催化剂,促使临床试验向远程化转型。
关注
03
与医生保持沟通
由于疫情,几乎所有的医生面访都被取消。许多制药和生命科学公司在疫情早期就认识到,员工在医院之间往返和与医生的面访可能暗藏风险,因此也主动减少了这些互动。但是,医生对信息的需求仍然存在。数据显示,远程沟通很好地弥补了这一缺憾。与2019年同期相比,所有调研国家的面对面沟通都大幅减少,而大多数国家的远程沟通都有所增加(见图3)。以何种形式、在何时进行沟通是现在需要讨论的话题。
关注
04
医药创新及新产品上市
COVID-19将对医疗健康行业的创新进程形成长期挑战。目前,医疗系统专注于处理疫情带来的危机,以及对医疗机构的管制措施,非新冠疫情相关领域的临床研究因此面临诸多现实挑战。
创新药的审批取决于药企与监管机构(尤其是FDA和EMA)之间的常规互动和指导工作。然而,为了应对当前的危机,监管机构委员会和工作组已转为远程办公,工作人员的时间精力不可避免地放在了COVID-19治疗药物的审批,以及与疫苗研发相关的临床试验上。因此,在疫情蔓延全球的几个月内,其他产品的审批和上市都有可能放缓。3月24日,波兰药监局(URPL)建议不启动新的临床试验,并将暂停对临床试验的检查。截至3月24日,BMS和礼来均已宣布暂停新试验。
IQVIA对3月28日至4月2日期间处方药销售量排名前20位的药企及其他较小规模公司的公告进行了研究。研究发现,在销量前20的药企中,有不到一半的公司宣布其临床试验受到疫情的负面影响,多数企业已宣布新临床试验将延迟启动。在较小规模的企业中,则有更多公司表示其现有试验已受到影响(见图4)。相较而言,暂停药品上市的公告鲜少出现。
远程临床试验方法已研究多年,这次疫情使得其价值得以凸显。3月18日,FDA针对制药行业、调查人员和审查委员会发布了关于疫情期间进行临床试验的指南,坦承当前临床试验所面临的挑战,并强烈建议通过远程和虚拟化方法尽可能维持临床试验的进行。
除临床研发外,药企还面临着近几个月内产品上市计划的艰难决策。在所有国家和地区,药企都必须认识到,如果现在暂停产品上市计划,疫情结束后,它们面临的将是一个截然不同的产品上市环境,上市计划的各个方面都会被审核和修改,而医疗系统的恢复也很可能要耗费相当长的时间,甚至要持续到2021年。
最明显的变化可能是需要持续与医生进行远程沟通。对营销活动而言,远程拜访的重要性已日渐提升。从产品上市第一年营销活动的组成来看,早在 2018 年,在七个主要国家市场中(占产品上市前五年销售额近90%),商业化最成功的上市活动就已是数字化营销程度最高的活动。疫情后,我们预计产品上市计划、医生沟通将进一步发生变化。这不仅包括数字化渠道利用率的提高,更将改变医生对营销渠道和营销内容的期待。询问医生变化后的偏好,调整策略以回应医生的反馈,将变得至关重要。
除营销活动外,其他产品上市活动也必将发生变化。疫情后,市场准入的大环境将面临资源和预算的紧缺。虽然有针对COVID-19的大量紧急资金,但其他治疗领域的资金将被削减。医疗系统对新产品的价值判断可能会随之改变,举例来说,有可能让患者不需要进医院的产品(如皮下注射,相较于静脉注射),或减少医患接触次数的产品(如智能用药设备)价值突显,更受医疗系统青睐。
概括而言,产品上市后,所有复杂的业务协调工作都必须考虑以远程的方法来进行,包括内外部会议、项目启动、信息更新、产品培训和医患教育等环节,以及顾问委员会的工作等。正常情况下,产品上市背后的一系列协调工作就颇具挑战性,在当今的特殊情况下,企业需要认识到这种挑战性,并做出更大的努力去应对。
关注
05
规划中长期连续性战略影响
在当前形势下,企业制定危机后的中长期规划至关重要。医疗健康体系和医药市场不会迅速恢复常态。实际上,就医疗系统和医药业务的一些基本方面而言,疫情可能会成为未来长期重大变革的催化剂。药企必须保持警惕,密切关注行业变化。
远程沟通和远程临床试验可能会更加普及,医疗健康行业或将加速数字化转型,远程拜访的兴起对已积极部署远程医疗和远程沟通技术的科技公司起到了强大的推动作用。最后,全球制造业和供应链之间日益强化的依存关系也可能减弱,甚至反其道而行之。
COVID-19疫情是一个世界历史变革性事件,对于身处抗疫中心的生命科学行业更是如此。除了面临保证药品流通、找出治疗方法和研发疫苗的挑战外,作为高度创新的行业,医药领域也在疫情下激发了更多创新之举,拥抱着前所未有的快速革新机会。

