血脑屏障(BBB)通过形成神经血管单元(NVU)来维持中枢神经系统(CNS)的稳态。该单元包括内皮细胞(ECs)、周细胞和星形细胞终足,这些细胞共同维持正常的大脑功能。然而,BBB也阻碍了对脑肿瘤的治疗。
BBB在肿瘤进展过程中被破坏,然后被称为血肿瘤屏障(blood–tumour barrier,BTB)。
虽然BTB比BBB具有更强的渗透性,但其对小分子和大分子的异质通透性以及异质灌注有助于脑肿瘤中药物积聚。

神经血管单元(neurovascular unit, NVU)
BBB内皮细胞和神经实质细胞共同构成NVU,在中枢神经系统中充当“守门人”,严格控制分子和细胞的跨细胞和细胞旁通路交叉。
a. 神经血管单元毛细血管(NVU)与完整的血脑屏障(BBB,左下角)和破坏的血-肿瘤屏障(BTB,右下角)在神经实质的示意图。BBB的发育和通透性是由NVU中多个细胞调控的信号和结构机制决定的。这些机制控 和跨细胞途径,最终控制中枢神经系统(CNS)的血管通透性。
b.调节内皮细胞(ECS,红色)和NVU发育、成熟和功能的细胞和分子组分的示意图。
神经元(紫色)和非神经元细胞调节ECS中转运蛋白和紧密连接蛋白的表达,这反过来又可能“松开”或“收紧”BBB。
通过改变转运蛋白的表达,以及通过破坏连接蛋白复合物改变细胞旁转运途径,这些途径将共同或单独改变跨细胞转运。
值得注意的是,ECS相互调节NVU的成分。例如,由EC分泌的TGF-β可以激活周细胞上的同源受体,在发育和成熟过程中,胶质细胞、周细胞和神经元通过多个配体和受体调节EC行为,这些配体和受体反过来激活下游信号级联(例如,Frizzled、G蛋白耦合受体124(GPR124)、β-catenin、gli、PI3k、SRC和p38MAPK),这些级联决定连接蛋白和跨细胞蛋白的表达,并控制CNS稳态。
例如,星形胶质细胞通过主要水通道蛋白4(AQP4)直接调节神经实质间隙中的水分含量等,通过特异性趋化因子和细胞因子的产生,调节免疫细胞和癌细胞的浸润,部分通过血管紧张素(AngI和AngII)、载脂蛋白e(APOE)和维甲酸调节BBB通透性和完整性,调节周细胞的分布。
c.在BTB中,NVU的完整性和内皮通透性由于NVU的破坏而受到损害,包括星形胶质细胞(蓝色)和周细胞(绿色)的移位、神经血管解耦、周细胞群体的改变以及EC紧密连接和转运机制的改变。
额外的血管相关表型,如缺氧,水肿,血管生成和肿瘤血管共同选择,可以影响脑肿瘤的NVU。虽然BBB特征在肿瘤发展过程中仍然存在,特别是在癌-神经实质边缘,BTB表现出增加异质通透性。肿瘤的进展导致BTB结构的改变,包括神经元死亡、星形胶质细胞内足位移(来自原发性和转移性癌细胞)以及异源周细胞和星形胶质细胞亚群,所有这些都能降低中枢神经系统内皮的屏障功能。在示意图中,细胞内囊泡运输由灰色囊泡表示。
BBB功能
血脑屏障被基底层包围,这是一种细胞外基质(ECM),主要由糖蛋白组成,可被蛋白酶裂解,影响BBB在健康和疾病中的功能。
ECs、周细胞和星形胶质细胞对基底层起作用,它提供配体,激活NVU中的多种信号通路(比如GPCR/GPR124 和 WNT–β- catenin 轴),调节BBB功能。
中枢神经系统内皮细胞被认为是非开窗的,因为它们在其细胞膜中显示出减少的孔隙,并且具有有限的细胞内囊泡转运和胞吞作用。
Cargo在BBB上的跨细胞运动形式为囊泡介导的转运,涉及受体介导或吸附途径,或载体介导的转运,调节激素、转铁蛋白和血浆蛋白的转运。
被动BBB扩散在很大程度上取决于小分子的亲脂性。小亲脂分子,如氧和咖啡因,通过细胞膜扩散。
中枢神经系统内皮细胞表现出极化的细胞转运体,动态调节神经实质与血液之间的内流和流出。小的亲水分子,如葡萄糖和氨基酸,通过溶质载体(SLC)蛋白穿过BBB。激活转运,通过血管壁的腔内和腔侧存在的ATP结合转运体(ABC转运体)的极化表达来实现。
这些转运体介导异种生物和毒素从内皮细胞流出,远离神经实质间隙,有效地清除这些进入腔内室药物。
大多数抗肿瘤低分子量药物是ABC蛋白的底物。例如,针对胶质瘤和脑转移瘤的几种靶向治疗方法对多药耐药(MDR)ABC转运蛋白、p-糖蛋白(p-gp;又称ABCB1)、乳腺癌耐药蛋白(BCRP;又称ABCG2)和多药耐药蛋白(MRPs)具有亲和力,这些蛋白都在BBB中表达。
内皮腔侧的周细胞是整个身体血管功能的关键调节因子,在衰老过程中控制血管功能、血管重塑和神经炎症。除了与NVU中的星形胶质细胞交流外,周细胞支持出生后大脑中的BBB维持。
周细胞可以直接调控转运蛋白的表达。NLS1调节DHA在血脑屏障中的转运,是神经元功能和神经保护所必需的。
肿瘤BBB/BTB的破坏及异质性
由于大脑内的空间有限,肿瘤的生长压迫血管来抑制瘤周的血流。随着脑肿瘤病变的扩大,肿瘤核心与肿瘤外周的NVU获得不同的特性,外周包含一个完整的BBB。在原发性脑肿瘤的进展和脑转移的发展过程中,肿瘤血管变得越来越异质化。肿瘤的扩大会引起局部和远端的改变,从而直接损害神经元的活力和血管功能,增殖的癌细胞的营养需求需要选择现有的血管和/或通过血管生成创造新的血管,肿瘤还可以通过其他机制增加血管供应:血管生成,血管模拟和转分化。
肿瘤进展过程中的血管功能障碍,部分由血管内皮生长因子(VEGF)等血管生成因子的表达失调控介导,导致缺氧和酸性微环境,部分通过缺氧诱导因子1α(HIF1α)诱导的转录程序推动肿瘤进展。血管正常化是肿瘤治疗的重要方向也是一个挑战。抗血管生成治疗的一个不利后果,高剂量产生的缺氧可以增加癌细胞的侵袭性。此外,VEGF本身可以调节BBB的通透性;因此,高剂量的抗血管生成可能降低BTB的通透性,这可能会影响其他治疗药物的传递。在这些血管表型之间实现最佳平衡仍然是原发性脑肿瘤和脑转移瘤的抗血管生成治疗的挑战。
临床前研究表明,尽管BTB平均泄漏较多,但也表现出异质性的通透性。脑肿瘤的NVU细胞及分子被破坏,在小鼠和人脑转移中,周细胞亚群发生了改变,与未受影响的血管区相比,结蛋白阳性的周细胞在很大程度上填充了药物可渗透的BTB,在反应性星形胶质细胞和脑转移癌细胞中表达的鞘氨醇1-磷酸受体3(S1PR3)通过星形胶质细胞IL-6和CCL2分泌使BTB松弛,在成熟的中枢神经系统中,EC S1PR1信号也可以调节BBB的完整性。
在胶质母细胞瘤中,BTB还表现出异常的屏障特征,如TJS减少、不均匀的周细胞覆盖和干细胞衍生的周细胞,从而破坏肿瘤进展过程中的血管完整性。胶质瘤干细胞被认为是难以治疗的,存在于维持“干细胞”的血管周围、缺氧和侵袭性生态位中,并显示出异常的屏障完整性。泄露和功能失调的血管会导致水和代谢废物滞留在神经实质间隙,增加间质和颅内液体压力,往往需要糖皮质激素治疗以减少恶性脑瘤的水肿,在胶质瘤的临床前模型中针对胶质瘤干细胞衍生的周细胞破坏BTB,并增强药物传递。
在开发有效的系统疗法时,必须考虑脑肿瘤微环境中BBB/BTB的结构和功能异质性。
完整神经血管单元特点
大脑血管有12平方米的内皮细胞用于运输
周细胞覆盖80%的脑毛细血管表面
基底层具有~60nm孔隙的ECM网络
100%的500da分子和98%以上的小分子不能通过BBB
扩散:冻干分子和离子/水通道,溶质载体
转运:NVU中10-15%的蛋白质是转运体
维持离子梯度和pH,并缓冲神经元活动的副产物
肿瘤破坏神经血管单元
改变转运体和连接蛋白的表达,保留药物屏障功能
非均质渗透性
完整性降低促进细胞、小分子和大分子迁移
结蛋白(desmin1)、层粘连蛋白2和S1P3是渗透性BTB的标志
星形细胞的失去末端连接
活化胶质细胞等NVU细胞与癌细胞相互作用,调节增殖、药物反应和免疫细胞外渗
可以利用BTB特性来增加药物的释放
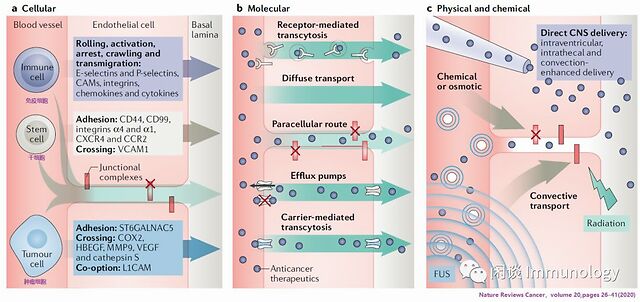
跨BBB/BTB药物递送
完整的BBB对于药物甚至小分子药物都是一个难以逾越的屏障,循环药物受到NVU造成的多重障碍:减少亲水分子的细胞间转运,减少跨细胞转运和调节极化外排型转运体,从而阻止亲脂合成分子进入神经实质。
提高跨血脑屏障转运
细胞途径
干细胞归巢能力,可以实现药物特定部位的定向传送,神经干细胞(NSCs)和间充质干细胞(MSCs)已经成为脑部药物传输的首选载体。干细胞在BBB的迁移可能与免疫细胞的浸润有些类似(包括滚动,黏附,跨膜迁移等,但使用的分子和免疫细胞不同,这个过程受到细胞因子和趋化因子的影响)。已经有了第一次在人体的用药(文献7)。
免疫细胞外渗到中枢神经系统(CNS)是通过以下步骤进行的:滚动、激活、静止、爬行、迁移。当血脑屏障完好无损时,首选跨细胞途径,而当紧密连接完整性降低和细胞间间隙形成时,首选外排型途径。
脑转移的肿瘤细胞通过一系列酶来破坏BBB的完整性,黏附爬行通过。
分子途径
劫持内源性内流运输
受体介导的跨膜转运,可以经药物偶联在受体的配体上,实现药物的跨膜转运,应将开始进行临床试验(文献10)
克服排放泵的问题
外排泵产生低的脑-血药物比,因为其通过足够亲合力,可以将药物从脑部排出,外排转运体包括P-gp和BCRP。现在临床前研究将转运体抑制剂和药物联合使用,可以增加化疗药物在脑部的浓度,比如可以将BRAF inhibitor
vemurafenib浓度增加40倍(文献11)。此外改变抑制剂结构,降低与转运体P-gp和BCRP结合,也是一个方法。
物理方法: 聚焦超声
低强度聚焦超声脉冲和循环微泡(脂质微体、白蛋白或聚合物壳气囊(1-10μm)-结合在一起),散射声音和振动以响应超声波,提供了一种物理方法来短暂破坏BBB/BTB(6-24h)而增加通透性。超声增加顺铂治疗脑胶质瘤的临床二期已经开展(文献12)