前言
哺乳动物皮肤、气道和肠道等上皮屏障,是宿主免疫防御的第一道屏障。因而适应环境暴露,形成快速反应机制,是屏障组织的一种保守特性。
屏障组织,在接收新的刺激,形成免疫防御事件后,以最佳的方式进行记忆存储。当再次遇到外界微生物等信息时,他们快速检索之前的记忆存储,启动快速的免疫应答,以便第一时间间清除不良信息,保护机体。
经典免疫记忆(炎症记忆)被认为主要由适应性免疫系统承担,但是越来越多的研究显示,组织实质细胞也在参与免疫记忆。
记忆存储或检索中的偏差会使组织产生病理后果:记忆不足会导致感染增加;过度的记忆检索会导致慢性炎症;恶性肿瘤可能是由于记忆不足和过度记忆所致。
组织免疫记忆的细胞类型及特点
B细胞及浆细胞(第一层防御主力)
记忆B细胞和终末分化浆细胞产生抗原特异性抗体,以保护上皮细胞免受细菌定植和随后的侵袭。如果这些抗体中和了局部环境中的抗原,则可以避免使用下一级的免疫防御系统。
比如流感感染,肺部长期存活的生发中心储留的记忆B细胞(表达CD69和 CXCR3)分泌IgA和IgG,启动病毒清除。B细胞记忆,可以阅读之前的文章:
T细胞(中坚力量)
如果微生物病原体逃避抗体免疫防御,并成功地渗透到上皮屏障,传统的T细胞介导的效应程序就会提供下一层特异性免疫。
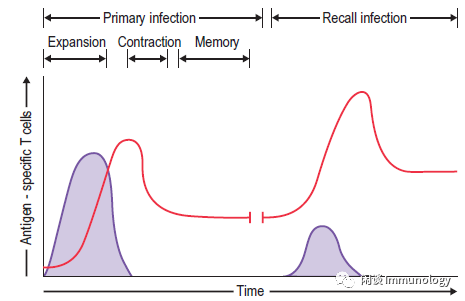
CD8+T细胞对于清除内病原体和恶性细胞至关重要。激活后,抗原特异性CD8+T细胞增殖并分化为一个异源群体,通过细胞溶解和炎性细胞因子提供免疫防御。
效应细胞群体的一部分是终末分化的-提供即时、急性的功能,在感染解决后凋亡。一部分形成表型,功能异质性的长期存活记忆性群体。
根据表型及功能,记忆T细胞可以分为六类,如下表:
记忆T细胞以不依赖抗原的方式维持;需要细胞因子IL-7和IL-15。
IL-7和IL-15启动下游JAK-STAT信号传导,随后通过调节增殖相关、抗凋亡和促凋亡基因的表达,激活促进稳态增殖和T细胞存活的转录因子。IL-7已被证明支持记忆T细胞的代谢适应性( 比如 诱导glycerol channel aquaporin 9,允许摄取甘油,用于甘油三酯的合成和储存,以满足记忆T细胞的代谢需要;嘌呤能受体p2rx7最近也被证明对小鼠TCM和TEM分化线粒体稳态和代谢功能相关)。
先天淋巴细胞和先天样T细胞
没有淋巴结(再)教育的情况下产生细胞因子的常驻记忆T细胞,是先天淋巴细胞(innate lymphoid cells,ILCs)和先天样淋巴细胞特点。
抗原特异性驻留记忆T细胞,类似于ILCs,可以通过产生作用于其他驻留细胞亚群的IFN-γ,来激活组织警报或警觉。
记忆在抗原特异性细胞亚群中的分布,可能有助于通过TCRs和BCRs更广泛地感知环境暴露,以及比先天淋巴细胞和/或先天样淋巴细胞更适合的细胞状态输出。
巨噬细胞和树突状细胞
巨噬细胞和树突状细胞亚群有着共同的核心发育细胞类型识别方案,以及由其局部环境驱动的组织特异性细胞状态适应。
训练的免疫(trained immunity) ,巨噬细胞初次暴露可以重编程髓系细胞以便接收第二的病原相关分子模式(PAMPs)或者不同微生物的暴露。
胎儿来源的巨噬细胞亚群相对于被招募的组织驻留单核细胞重要性仍有待确定,但这方面的基础工作强调,骨髓中的髓系祖细胞存在功能上重新编程。
早期关于训练的免疫在组织中的作用的研究表明,来自T细胞的IFN-γ可直接产生肺泡巨噬细胞,这与病毒暴露后保护的增强有关。目前的工作还在研究环境反应转录因子(如PPARγ)和细胞因子反应转录因子(如STAT6)如何协同改变巨噬细胞细胞状态。巨噬细胞介导的训练免疫如何在更广泛的组织免疫背景下运作?
上皮细胞
如果免疫事件被上皮细胞直接记住,祖细胞将作为其启动的候选进行储存,因为终末分化细胞的记忆可能会迅速丢失。一项开创性研究强调,短时间的牛皮癣样炎症可以从根本上改变皮肤上皮干细胞,以更快地修复该部位随后的伤口。皮肤驻留巨噬细胞或T细胞都没有参与这一过程。但是AIM2-caspase1-IL-1β轴对于在稍后祖细胞记忆是必不可少的。祖细胞的炎症记忆状态持续至少180天,表现出反应的持久性。
鉴定非免疫细胞可能在组织维持人类炎症性疾病。另一项单细胞RNA测序研究慢性鼻窦炎,发现2型细胞因子IL-4和IL-13直接作用于基底气道上皮祖细胞,改变其细胞状态并抑制其分化能力。这些细胞可以作为过敏性炎症记忆的储存库。
免疫事件的记忆可以通过不同的传感器由上皮祖细胞整合,改变它们在不同屏障组织和物种上的回忆反应和功能结果。
基质细胞
基质细胞包括成纤维细胞、血管和淋巴管内皮细胞。
基质细胞具有关键的免疫功能,在很多环境中诱导病理性改变,导致纤维化,细胞因子参与了此过程。
基质细胞也可以表现出炎症记忆的特征。
神经元
自主神经和外周感觉神经元可以通过与特定免疫细胞亚群的直接对接,对屏障组织的免疫过程进行实质性调节。
皮肤中的热敏神经元的一个特定子集驱动真皮树突状细胞产生IL-23,导致真皮细胞产生IL-17,并促进银屑病样炎症。这一途径只能通过激活光遗传学上的神经元来触发,并且在白色念珠菌皮肤感染期间有利于宿主的防御。
最近的证据表明,神经元激活细胞体或外周轴突可以影响回避行为和预期的外周免疫反应,即使在没有其他炎症信号的情况下也是如此,因为在一定程度上提示有免疫记忆。
喵评:机体是一个精细调节的整体,各类细胞除了术业有专攻,还相互帮衬......
主要参考文献
Adachi, Y. et al. Distinct germinal center selection at local sites shapes memory B cell response to viral escape. J. Exp. Med. 212, 1709–1723 (2015).
Dougan, S. K. et al. Antigen- specific B- cell receptor sensitizes B cells to infection by influenza virus.Nature 503, 406–409 (2013).
Arsenio J, Kakaradov B, Metz PJ, Kim SH, Yeo GW, Chang JT:Early specification of CD8+ T lymphocyte fates during adaptive immunity revealed by single-cell gene-expression analyses. Nat Immunol 2014, 15:365-372.
Kaech SM, Cui W: Transcriptional control of effector and memory CD8+ T cell differentiation. Nat Rev Immunol 2012,12:749-761.
Schenkel, J. M. et al. T cell memory. Resident memory CD8 T cells trigger protective innate and adaptive immune responses. Science 346, 98–101 (2014).
Ariotti, S. et al. T cell memory. Skin- resident memory CD8+ T cells trigger a state of tissue- wide pathogen alert. Science 346, 101–105 (2014).
Kotas, M. E. & Locksley, R. M. Why innate lymphoid cells? Immunity 48, 1081–1090 (2018)
Arendt, D. et al. The origin and evolution of cell types. Nat. Rev. Genet. 17, 744–757 (2016).
Itziar Martinez-Gonzalez,Immunological Memory of Group 2InnateLymphoid Cells,Trends inImmunology,2017
Gosselin, D. et al. Environment drives selection and function of enhancers controlling tissue- specific macrophage identities. Cell 159, 1327–1340 (2014).
John R Grainger & Richard K Grencis,Neutrophils worm their way into macrophage long-term memory,nature immunology,volume 15 number 10 october 2014
Ordovas- Montanes, J. et al. Allergic inflammatory memory in human respiratory epithelial progenitor cells. Nature 560, 649–654 (2018).
Naik, S. et al. Inflammatory memory sensitizes skin epithelial stem cells to tissue damage. Nature 550, 475–480 (2017).
Jose Ordovas- Montanes,Distribution and storage of inflammatory memory in barrier tissues,Nature Reviews Immunology,2020
Crowley, T., Buckley, C. D. & Clark, A. R. Stroma: the forgotten cells of innate immune memory. Clin. Exp. Immunol. 193, 24–36 (2018).
Cohen, J. A. et al. Cutaneous TRPV1+ neurons trigger protective innate type 17 anticipatory immunity.Cell 178, 919–932 (2019).
Ben- Shaanan, T. L. et al. Activation of the reward system boosts innate and adaptive immunity. Nat. Med. 22, 940–944 (2016).