作者 l 郭佳
核酸药物是生物医药发展的前沿领域,包括反义核酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)适配体(aptamer)、核酶(ribozyme)、抗体核酸偶联药物(ARC)等,是基因治疗的一种形式,也是继小分子药物、蛋白药物、抗体药物之后的新一代制药技术,本文将对上述各细分领域进行综述。
先来说说最近核酸药物领域的标志性事件:
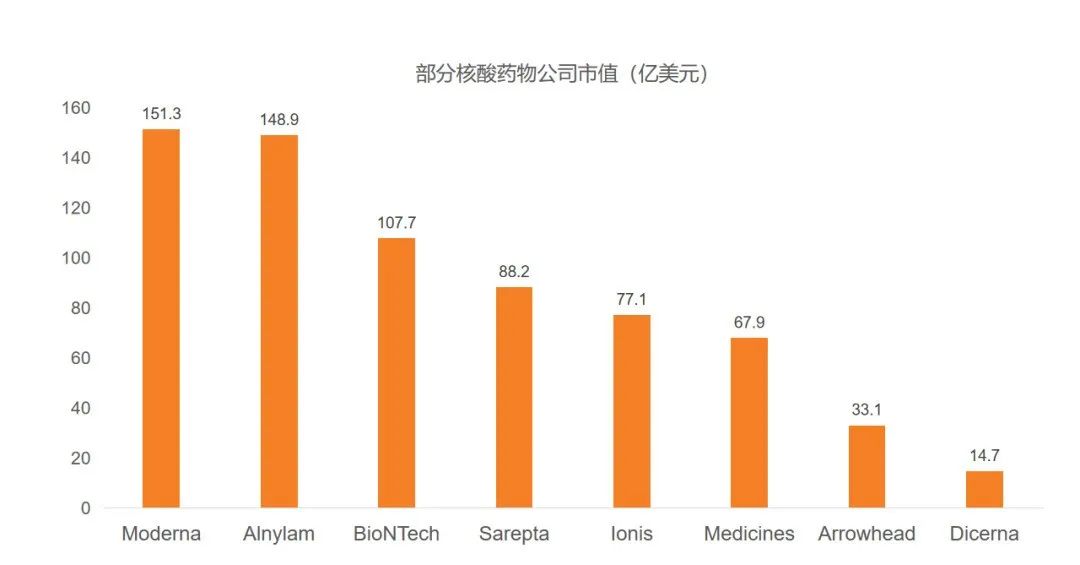
2020年4月14日,Alnylam公司获得黑石集团20亿美元的投资来支持其RNAi疗法vutrisiran和ALN-AGT等在研药物的开发,黑石将获得inclisiran(一款靶向PCSK9的治疗高胆固醇血症的RNAi疗法)未来销售额分成的50%,截至目前Alnylam公司市值148.92亿美元。同时黑石集团联合创始人苏世民(Steve Schwarzman)与红杉资本沈南鹏的抖音对话使其被圈内外所熟知,其大手笔的投资也正式助推核酸药物步入黄金时代。
2020年4月3日,瑞博生物宣布获得4.7亿元人民币的C2轮融资支持,本轮融资由中国国有资本风险投资基金领投,中金启德基金、高瓴创投联合领投,恒旭资本、朗玛峰创投、国药中金基金、深圳众汇、上海自贸区基金和弘陶资本等知名投资机构共同跟投。瑞博生物董事长梁子才博士表示:“随着两个国际小核酸药物的接连面市,小核酸制药经过近二十年的卧薪尝胆,开始进入产业收获期。
随着新冠疫情的爆发,mRNA疫苗相信大家已经不再陌生,而这一领域的研究在美国早已步入快速商业化。2020年4月16日,Moderna 与美国生物医学高级研究与开发局(BARDA)达成协议,将获得最高4.83亿美元的资金支持,用于支持测试和生产mRNA-1273疫苗;也正是这家公司在2018年底以6.04亿美元的募资创下了生物科技公司规模最大的IPO纪录,截至目前市值151.31亿美元。另一家mRNA疗法公司BioNTech也于2019年10月10日正式在纳斯达克,截至目前市值107.68亿美元。
2019年12月12日,Sarepta公司宣布FDA批准其反义寡核苷酸(ASO)药物Vyondys 53(golodirsen),用于治疗外显子53跳跃(exon 53 skipping)的杜氏肌营养不良症(DMD)患者。
2019年11月20日,FDA批准Alnylam公司的RNAi疗法Givlaari(givosiran)用于治疗急性肝卟啉症(AHP),这是全球第二款siRNA药物获批上市;全球第一款siRNA药物也是由Alnylam公司开发的,即于2018年8月10日获得FDA批准的Onpattro (patisiran),用于治疗成人患者因转甲状腺素蛋白淀粉样变性(hATTR,也称家族性淀粉样多发性神经病变)引起的神经损伤,也是第一个用于治疗 hATTR的药物。
2019年10月7日,辉瑞宣布与Akcea达成ASO药物AKCEA-ANGPTL3-LRx授权协议,获得AKCEA-ANGPTL3-LRx全球开发、商业化权益,全权负责产品II期以后的开发和商业化;Akcea 和 Ionis将获得2.5亿美元首付款, 13亿美元里程碑金,外加销售提成。
2019年5月3日,由Ionis开发的反义寡核苷酸(ASO)药物Volanesorsen (Waylivra)获得欧洲药物管理局(EMA)批准上市,用于对饮食控制和降甘油三酯疗法控制不佳、存在胰腺炎高风险、并且经基因检测证实的家族性乳糜微粒血症综合征(FCS)成人患者的治疗。

图一. 核酸药物上市公司市值表现
一系列突飞猛进的里程碑式事件,让卧薪尝胆多年的核酸药成为耀眼的“新星”!本文将对整个核酸药物领域进行深度盘点。
1
核酸药物及临床应用统计
核酸是由许多核苷酸聚合成的生物大分子化合物,为生命的最基本物质之一。根据化学组成不同,核酸可分为脱氧核糖核酸(DNA)和核糖核酸(RNA)。DNA是储存、复制和传递遗传信息的主要物质基础,RNA在蛋白质合成过程中起着重要作用。

图二. 核酸结构
核酸药物则是各种具有不同功能的寡聚核糖核苷酸(RNA)或寡聚脱氧核糖核苷酸(DNA),能够直接作用于致病靶基因或者靶mRNA,在基因水平上发挥治疗疾病的作用,如由于基因突变可能引起某个重要功能基因的转录变化,导致相应的蛋白出现过多、过少表达或者突变,诱发特定疾病,核酸药物从转录后水平进行基因沉默或激活治疗,相比传统蛋白水平发挥作用的药物具有高特异性、高效性、长效性等明显优势。
核酸药物多年来发展曲折,富有挑战的是其注射进入人体后,如何存留足够时间以准确靶向到病变部位,同时避免损伤正常细胞,归根结底是研发出高效安全的药物递送系统,以解决核酸药物递送、稳定性、脱靶效应等难题。

图三. 代表性小核酸药物递送系统 [1]
2020年4月27日,Nature Reviews Drug Discovery杂志上发表了题为《RNA therapeutics on the rise》的文章,分析了目前全球431个核酸药物在研项目。在这些候选药物中,63%处于pre-IND阶段,32%处于早期临床试验(I期或II期),3%处于III期临床,5种药物处于NDA [2]。适应症领域以肿瘤排在首位,其余适应症分布较为平均,如下图所示。

图四. 核酸药物适应症和研究阶段[2]
二
核酸药物种类和国外研究进展
核酸药物主要包括反义核酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)、适配体(aptamer)等等。

图五. 核酸药物作用通路[1]
(a)小干扰RNA(siRNA)与(b)微小RNA(miRNA)的作用通路;(c)miRNA拮抗核酸作用机制;(d)小激活RNA(saRNA)的工作模式;(e)反义核酸(ASO)作用方式;(f)信使RNA(mRNA)疗法的特点
01、反义核酸药物(ASO)
哈佛大学科学家Zamecnik等于1978年首次提出了反义核酸(Antisense oligonucleotides,ASO)的概念。反义核酸是指与mRNA互补后,能抑制与疾病相关基因表达的RNA,可通过不同机理安全用于人体。期作用机制包括:1)非RNaseH依赖的调控机制:这是最初发现ASO时的简单想法,利用ASO通过空间位阻效应调控基因的转录,实现RNA前体的选择性剪接、蛋白翻译的抑制等功能。2)RNase H依赖的调控机制:这一机制是后来研究发现的,在当时比较出人意料,即ASO与靶基因mRNA互补匹配后,招募RNase H,RNase H将靶mRNA剪切,阻断靶基因的蛋白翻译(图五e)。目前全球有7款ASO药物获批上市,有超过50个ASO药物处于临床研究阶段。已批准ASO药物中有5个为Ionis研发,2个由Sarepta研发,如下所示:

1)Vitravene (Fomivirsen):由Ionis同Novartis联合研发,1998年上市。该药物由21个硫代脱氧核苷酸组成,主要用于治疗艾滋病患者并发的巨细胞病毒(CMV)性视网膜炎,推荐治疗方案为第1个月每15天玻璃体内注射330μg,以后每月给药1次。通过对人类巨细胞病毒(CMV) mRNA的反义抑制发挥特异而强大的抗病毒作用;疗效维持久,给药次数少,不良反应轻。但后来由于巨细胞病毒病例数量急剧下降,该药在欧洲及美国分别于2002年及2006年退市。
2)Kynamro (Mipomersen):2013年1月29日,FDA批准Ionis公司的Kynamro (mipomersen sodium)用于纯合子型家族性高胆固醇血症(HoFH)患者。该药是一种以人类Apo B-100 mRNA为靶点的ASO,作为降脂药物和饮食的辅助药物,以降低低密度脂蛋白胆固醇(LDL-C)、载脂蛋白B (Apo B)、总胆固醇(TC)和非高密度脂蛋白胆固醇(非HDL-C)。Kynamro的用法为200mg皮下注射,每周1次。
3)Exondys 51 (Eteplirsen):该药物由Sarepta Therapeutics研发,于2016年9月19日获得美国FDA加速批准上市,是首个获批治疗杜氏肌营养不良症(DMD)的药物。Eteplirsen采用了一种新颖的磷酰二胺吗啉代寡核苷酸和外显子跳跃技术,修复mRNA的阅读框来部分纠正遗传缺陷。作为一种反义RNA,Eteplirsen跳过外显子51表达,帮助患者合成一些有一定功能形式的抗肌萎缩蛋白,延缓DMD病人行走和运动能力的退化。该新药跃过的是第51号外显子,大约13%的DMD症患者可能适合针对跃过第51个外显子的治疗方案。
4)Spinraza (Nusinersen):该药物由Ionis研发,2016年12月23日获得美国FDA批准上市,是用于治疗脊髓性肌萎缩症(SMA)儿童和成人的首个药物,于2017年6月1日获得欧洲EMA批准。Spinraza是一种无色透明的注射液,采用鞘内给药方式。脊髓性肌肉萎缩症由SMN1失活变异造成,但人体还有一个序列极其相近的SMN2基因,但这个基因表达时缺失7号外显子,导致蛋白略短,很快被降解。Spinraza和SMN2前mRNA结合,促进7号外显子编入mRNA中,因此产生功能类似SMN1的蛋白。
5)Tegsedi (inotersen):2018年10月美国FDA批准Ionis 开发的药物Tegsedi(inotersen)上市,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)患者的多发性神经病(polyneuropathy)。Tegsedi是一种抑制人类TTR合成的ASO药物,它通过与编码TTR蛋白的mRNA相结合,能够导致mRNA的降解,从而降低TTR蛋白(野生型和突变型)的水平。该药是一种每周一次的皮下注射针剂,患者在家中就可以自我给药。
6)Volanesorsen(Waylivra):该药由Ionis开发,于2019年5月3日获得欧洲药物管理局(EMA)批准上市,是靶向载脂蛋白C-Ⅲ(Apolipoprotein C-III,APOC3)的ASO药物,作为家族性乳糜微粒血症综合征(FCS)成年患者控制饮食之外的辅助疗法。临床试验数据显示,治疗3个月后,与安慰剂相比,Volanesorsen将甘油三酯水平降低了77%;常见不良事件是注射部位反应和血小板水平降低。值得一提的是,在美国,虽然Volanesorsen在2018年5月获得了FDA咨询委员会推荐批准的积极意见,但却在2018年8月底被FDA拒绝,可能与Volanesorsen相关的血小板计数突然且意外降低的副作用有关,也可能对Ionis旗下Akcea公司提出的在临床试验中并未被验证过的血小板监测频率和方法存在疑问。
7)Vyondy 53(Golodirsen):2019年12月12日,FDA批准Sarepta研发的Vyondy 53(Golodirsen)用于治疗杜氏肌营养不良症(DMD)患者。这是公司继Exondys 51之后,第二款获批上市的外显子跳跃疗法。该药是一种磷酰二胺吗啉代低聚体(phosphorodiamidate morpholino oligomer - PMO)化合物,被设计为可以与抗肌萎缩蛋白前体mRNA的第53号外显子相结合,从而在mRNA剪接时排除或“跳过”这一外显子。这么做的原因是某些DMD患者的特定基因突变会造成阅读框移动,使得患者体内生成无用的抗肌萎缩蛋白,而外显子跳跃的做法可以消除阅读框移动,生成缩短但可以发挥功效的抗肌萎缩蛋白。
02、RNA干扰(RNAi)
RNAi的概念始于1998年,并很快就发展成为生物医药领域发展的热点,3年后,RNAi技术被《Science》杂志评为2001年十大科学进展之一,卡内基研究所的AndrewFire和马萨诸塞大学的Craig Mello因发现RNAi机制而获得2006年诺贝尔医学或生理学奖。2018年8月10日,经过20年等待,FDA批准首个基于此诺奖技术的新疗法——Alnylam公司研发的Onpattro(patisiran)。RNA干扰(RNAi,RNA interference)指的是,将与mRNA对应的正义RNA和反义RNA组成的双链RNA(dsRNA)导入细胞,可以使mRNA发生特异性的降解,导致其相应的基因沉默的现象。RNAi技术可以分为siRNA和miRNA两种机制。

图六. siRNA和miRNA相关的RNAi
miRNA与siRNA之间有许多相同之处:a.二者的长度都约在22nt左右。b.二者都依赖Dicer酶的加工,是Dicer的产物,所以具有Dicer产物的特点。c.二者生成都需要Argonaute家族蛋白存在。d.二者都是RISC组分,所以其功能界限变得不清晰,如二者在介导沉默机制上有重叠。e.miRNA和siRNA合成都是由双链的RNA或RNA前体形成的。
miRNA与siRNA亦有许多不同点:a.根本区别是miRNA是内源的,是生物体的固有因素;而siRNA是人工体外合成的,通过转染进入人体内,是RNA干涉的中间产物。b.结构上,miRNA是单链RNA,而siRNA是双链RNA。c.Dicer酶对二者的加工过程不同,miRNA是不对称加工,miRNA仅是剪切pre-miRNA的一个侧臂,其他部分降解;而siRNA对称地来源于双链RNA的前体的两侧臂。d.在作用位置上,miRNA主要作用于靶标基因3′-UTR区,而siRNA可作用于mRNA的任何部位。e.在作用方式上,miRNA可抑制靶标基因的翻译,也可以导致靶标基因降解,即在转录水平后和翻译水平起作用,而siRNA只能导致靶标基因的降解,即为转录水平后调控。f.miRNA主要在发育过程中起作用,调节内源基因表达,而siRNA不参与生物生长,是RNAi的产物,原始作用是抑制转座子活性和病毒感染。
2.1 小干扰RNA药物(siRNA)
小干扰RNA(Small interfering RNA,siRNA)有时称为短干扰RNA(short interfering RNA)或沉默RNA(silencing RNA),是一个长约20到25个核苷酸的双链RNA。siRNA是带负电荷的生物活性大分子,不具备对组织或细胞的靶向能力,穿透细胞膜的能力极差,在生理环境中也极不稳定,而且siRNA药物在细胞内的转运过程直接影响其生理功能。因此,siRNA的递送系统是制约siRNA药物发展的最关键因素。

图七. siRNA介导的RNAi作用机制
siRNA介导的RNAi所引起的基因沉默是一种重要的基因表达调控方式,其作用机制是外源性双链RNA被Dicer酶剪切成siRNA(或者直接导入合成的siRNA),与细胞质中的AGO蛋白结合成沉默复合体(RNA-induced silencing complex,RISC),siRNA解旋,其正义链被剪切降解,而结合反义链的RISC被活化,特异性结合靶mRNA并将其切断,引发靶mRNA特异性降解,阻碍特定基因的翻译并抑制基因表达,达到治疗疾病的效果。

图八. 国外主要siRNA药物公司
siRNA药物的第一次商业化高潮在2006,当时最著名的两家公司分别是Alnylam和Sirna。Sirna被默沙东以11亿美金收购;武田,罗氏和诺华纷纷与Alnylam签署巨额合同。然而在随后的几年,siRNA药物由于递送系统和免疫反应的问题遭受挫折,大公司离场,幸运的是Alnylam和Dicerna等公司通过裁员等措施度过寒冬,坚持下来,才有了今天的成就。

动画一. siRNA介导的RNAi作用机制
siRNA药物目前已有2个上市,均来自美国Alnylam公司;另外有20余个处于临床试验研究。已上市药物包括:1)Onpattro(patisiran):由美国Alnylam开发,获得美国FDA授予的突破性疗法认定、优先审评资格、快速通道资格和孤儿药资格。2018年8月获美国和欧盟批准,是一种能特异性沉默hATTR表达的siRNA药物,全球首款批准上市的siRNA药物及首个非病毒给药系统的基因治疗药物。Onpattro是一种脂质复合物注射液,将siRNA包裹在脂质纳米颗粒(LNP)中,静脉输注后药物直接递送至肝脏细胞内,沉默hATTR mRNA的表达,减少产生hTTR蛋白,逐渐减少周围神经中淀粉样沉积物(hTTR)的积累,用于遗传性ATTR(hATTR)淀粉样变性成人患者第1阶段或第2阶段多发性神经病的治疗。
2)Givlaari(givosiran):Givlaari于2019年11月20日获批,是Alnylam公司研发的全球第二款siRNA药物,是GalNAc偶联siRNA疗法的全球首次批准,标志着精密基因药物开发的一个重大里程碑。该药通过皮下注射给药,靶向氨基乙酰丙酸合成酶1(ALAS1),可持续显著降低诱导的肝脏ALAS1水平,从而将神经毒性血红素中间产物氨基乙酰丙酸(ALA)和胆色素原(PBG)降低至正常水平,用于治疗年龄在12岁及以上的急性肝卟啉症(AHP)青少年和成人患者。被授予突破性药物资格和孤儿药资格。该药每月给药一次。
2.2 微小RNA药物(miRNA)
微小RNA(microRNA,miRNA)是真核生物及某些大型病毒中长度为20~24个核苷酸的一类内源性的具有调控功能的非编码单链小分子RNA。截至2014年已经发现有28,645个miRNA 分子。
miRNA最被大家广泛熟知的功能为:1)靶向负调控基因的mRNA,介导mRNA降解。相比于siRNA,miRNA要复杂得多,一个miRNA可同时负调控多个mRN,而一个mRNA也被多个miRNA进行负调控。

图九. miRNA的负调控作用
除此之外的功能还包括:2)miRNA可与其他功能蛋白相结合;3)miRNA可能通过结合TLR受体并将其激活;4)miR369-3、microRNAs-Let-7被证明形成RISC复合物之后,结合了ARE序列,促进了靶标mRNA的翻译过程,这两个miRNA具有正反两种调控mRNA的作用;5)miRNA靶向调控线粒体相关基因mRNA,破坏了正常的线粒体功能;6)miRNA可直接激活基因转录过程,比如有研究发现miR-589复合物可结合cyclooxygenase-2 (COX2)启动子区序列,启动该基因的转录过程;7)miRNA可靶向负调控其他非编码RNA的前体RNA。
基于上述miRNA的多种生物学功能,使得其在多种病理过程中成为很有希望的治疗药物。目前,miRNA药物主要包括两种形式:miRNA类似物(miRNA mimics)和靶向miRNA药物(AntimiRs),该领域的药物最快的处于临床II期研究。
表一. 部分基于miRNA的临床研究[3,4]

进入该领域的知名公司如下所示:
图十. 国外主要miRNA药物研究公司

和siRNA药物一样,开发miRNA mimics及AntimiRS药物的主要难点在于进行结构修饰以增加其稳定性,以及选择优化药物递送系统。
2.2.1 miRNA mimics
miRNA mimics是模拟生物体内源的miRNA,体外合成后导入人体内,增强内源性miRNA负调控作用,介导mRNA降解,降低细胞内蛋白表达量,这一过程即为miRNA介导的RNAi作用机制。

动画二. miRNA介导的RNAi作用机制
2.2.2 AntimiRs
自20年前发现第一个miRNA,miRNA成为肿瘤新疗法的工具和靶点,并已经应用于肿瘤、抗病毒、代谢性疾病、单基因遗传病等。miRNA的异常表达及生物合成紊乱是许多癌细胞的重要特征,现有研究证明,miRNA可以与原癌基因相互作用发挥致癌或抑癌功能,例如,miR-15a和miR-16-1的缺失或下调可以导致抗凋亡基因bcl2表达的升高,引起白血病和淋巴瘤的发生;miR-143可以抑制结肠癌相关转移基因1(MACC1)的转录和翻译,抑制结直肠癌细胞的生长和侵袭能力。因此,选择合适的AntimiRs可以应用于不同机制的肿瘤治疗。
表二. miRNAs在癌细胞中的潜在作用靶点

在抗病毒领域,应用较多的是HCV领域。Regulus公司和Roche的HCV治疗产品均为抗miR-122的核酸片段,已在HCV感染患者中开展II期临床研究,可显著降低患者体内病毒滴度。miR-122仅在肝脏中产生,调节着很多基因的活性。
2.2.3 其他
《科学》杂志一篇题为“Deficiency of MicroRNA miR-34a Expands Cell Fate Potential in Pluripotent Stem Cells”的文章研究表明:miR-34a似乎是阻止ESC(人胚干细胞)和iPSC(诱导多能干细胞)产生胚外组织的制动器。当这种miRNA被遗传移除时,ESC(人胚干细胞)和iPSC(诱导多能干细胞)都能够扩展它们的发育范围,产生胚胎细胞类型以外的胎盘和卵黄囊细胞。令人惊讶的是,仅操作这一种miRNA就能够大大扩展ESC的细胞分化潜能。这对再生医学和基于干细胞的临床疗法开发具有重要意义。
尽管miRNA领域暂无上市药品,但随着科学的不断进步,miRNA新药的上市指日可待。
03、小激活RNA药物(saRNA)
RNA激活(RNA activation, RNAa) 是一种由小分子RNA介导的基因表达上调机制,是近来发现的由小分子双链RNA(double-stranded RNA,dsRNA)靶向作用于基因启动子区域、在转录水平诱导基因表达的基因调节现象,具有激活功能的小dsRNA称之为小激活RNA(small activating RNA,saRNA)。
RNA激活机制由加州大学旧金山分校的华人科学家李龙承教授和德克萨斯大学西南分校的David Corey教授在世界上首先发现并命名,随后进行了商业化,MiNA Therapeutics获得一项靶向p21的saRNA专利。该公司是RNA激活领域的龙头企业,其首个产品MTL-CEBPA联合索拉非尼治疗肝癌的临床试验已经进展到临床II期,勃林格殷格翰和阿斯利康纷纷携手MiNA进入saRNA药物领域。
其作用机理如下:和RNAi一样,RNAa也需要Argonaute(Ago)蛋白特别是Ago2的参与,处理和活化saRNA分子,并介导saRNA与其启动子上的靶位点结合。双链saRNA装载到Argonaute2(Ago2)蛋白,其中的一条链(过客链,Passenger strand)被Ago2从中间切断并从Ago2复合体中脱落;之后Ago2复合体通过主动转运机制进入细胞核,与RNA helicase A (RNA解旋酶A,RHA)形成Ago2-RHA复合体,复合体中的引导链(Guide strand)找到与其互补的基因序列并结合,招募polymerase-associated factor 1(聚合酶相关因子1,PAF1)形成RITA(RNA-induced transcriptional activation,RNA介导的转录激活)复合体,该复合体进一步招募和激活RNA polymerase II(RNA聚合酶II),导致mRNA表达的增加(该机制在药渡的文章《与诺奖技术“相反相成”的发现—RNA激活》中有详细表述 )。

图十一. RNAa作用机制(来源:Treating disease at the RNA level witholigonucleotides, Arthur A. Levin, N Engl J Med, 2019;380:57-70)
值得一提的是,目前除了MiNA Therapeutics外,华人科学家李龙承教授于2016年创立中美瑞康公司,是全球第二个专注开发saRNA药物的制药公司。

图十二. 涉及saRNA药物领域的公司
04、mRNA疗法
mRNA疗法——1)通过外源导入mRNA来纠正基因表达缺陷或异常,或2)将表达抗原蛋白的mRNA制成疫苗。mRNA疗法成本更低、表达蛋白更快,且没有基因整合风险,已成为近年来最具前景的前沿研究领域,mRNA疫苗和药物的相关研究正被快速推进,目前已有60余种mRNA制剂进入临床阶段[5]。

图十三. mRNA疗法示意图
(a)体外转录mRNA的结构;(b)mRNA递送载体示意图;(c)mRNA入胞表达目的蛋白
mRNA疗法的优势在于:1)一旦靶点确定,mRNA药物的发现和设计几乎是程序化的;2)一个mRNA药物可以同时表达多种蛋白,为多价疫苗以及多蛋白联合用药提供了独特的便利性;3) mRNA药物理论上可以覆盖包括单抗、细胞治疗、基因编辑在内的所有当前最热门的新技术,如ex-vivo细胞治疗的应用(参见文章:谢雨礼. 生物科技的下个10年:RNA药物王者归来. 同写意)。
mRNA的局限性在于稳定性和免疫原性,目前已在很大程度上得到解决,但体内递送问题仍是最大的技术瓶颈,相较于分子量较小的siRNA和ASO等核酸药物,mRNA的递送难度更大、更具挑战性[5]。
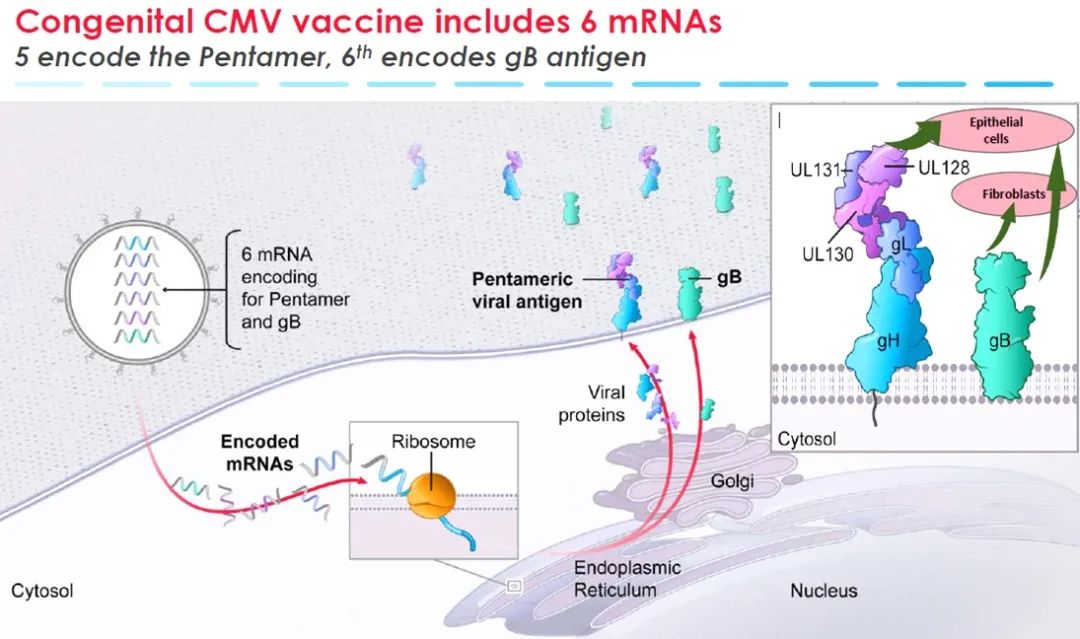
2020年1月Moderna首个mRNA疫苗mRNA-1647进入II期临床。mRNA-1476是一款由6种mRNA构成的CMV疫苗,5种mRNA编码CMV与细胞膜结合的五聚体复合物的不同亚基,一种mRNA编码糖蛋白B(gB)。这些蛋白对CMV感染上皮细胞和成纤维细胞非常重要。mRNA-1647旨在激发对这些蛋白的免疫反应,从而预防CMV感染。

图十四. mRNA-1476作用机制
目前暂无上市的mRNA疗法,全球mRNA疗法三巨头包括美国Moderna Therapeutics、德国BioNTech、德国CureVac;产品最快处于临床II期研究。

图十五. 国外mRNA药物公司
2018年12月,Moderna Therapeutics首次公开募股(IPO)募集了6.043亿美元,创造了有史以来最大规模的生物技术公司IPO,mRNA疗法从此成为热度不断的领域,包括这次新冠疫情,mRNA疫苗首当其冲。
目前mRNA药物临床研究大都没有问题,但是确实也有一些副反应的例子出现,引起注射部位或全身反应。因此在相关临床试验中要格外注意像局部和全身炎症、药物的生物分布、免疫原的持续表达、刺激抗体的自激活,还有非原生核苷酸及载体引入的成分所具有的潜在毒性等。
05、适配体药物(aptamer)
适配体(Aptamer)是一小段经体外筛选得到的寡核苷酸序列,其以独特的空间结构与相应的配体进行高亲和力和强特异性的结合,和其他核酸药物不同,适配体不是通过碱基配对来发挥作用,而是类似于抗体,依靠自身的三维结构与配体结合。与抗体相比,Aptamers获得难度和成本更低、免疫原性更低、组织穿透性好、靶标更广泛。
2004年FDA批准了全球第一个、由NeXstar公司研发的适配体药物Macugen(Pegaptanib),靶向VEGFR,用于治疗老年黄斑病变(AMD)。可惜VEGFR单抗Avastin上市后疗效和安全性优于Pegaptanib,在2006年Lucentis上市后Pegaptanib出局。随后,Fovista(anti-PDGF)和Reg1(anti-FIXa)两款临床阶段的适配体药物相继失败,适配体逐渐被工业界边缘化。
目前有十余款适配体药物处于临床研究阶段,研究进展参见文章(中国核酸制药全景图. 药渡.)。
06、其他
其他核酸药物还包括核酶(ribozyme)、抗体核酸偶联药物(ARC)、DNA疫苗(DNA vaccine)等。
核酶(ribozyme)是一类具有生物催化活性的小分子RNA。核酶可以特异性裂解靶RNA,从而阻止特定基因的表达。核酶在切断mRNA后,又可以从杂交链上解脱下来,重新结合并切割其他的mRNA分子。目前没有核酶类药物上市。
2019年4月,抗体核酸偶联(ARC)技术公司Dyne获得Atlas、MPM、Forbion等风投的5000万美元A轮支持。其核心技术为FORCE™,用ARC靶向递送罕见肌肉组织疾病,包括骨骼肌、心肌、平滑肌疾病。

DNA疫苗(DNA vaccine),又称“裸”DNA疫苗(naked DNA vaccine)、基因疫苗(genetic vaccine),亦有核酸疫苗(nucleic acid immunizaiton)等相关名称,其基本原理是直接向目标生物体内注射编辑过可以表达抗原蛋白质的DNA载体质粒,使它直接在生物体内产生抗原,刺激免疫系统产生抗体,是近年来基因治疗研究中所衍生并发展起来的一个新的研究领域。2020年4月6日,由盖茨基金会资助Inovio公司研发的新冠疫苗通过FDA审批,将开始人体试验,这是美国第二种获批开展人体试验的新冠疫苗,也是世界上第一种即将开展人体试验的DNA疫苗。
三
国内核酸药物代表企业
尽管国外核酸药物领域如火如荼,国内由于技术的限制,涉足核酸药物的公司屈指可数。
药物公司包括:瑞博生物、圣诺制药、天龙药业、中美瑞康、斯微生物、彭济凯丰、西安荣清畅、复星医药、舒泰神、绿叶制药、香雪制药、艾棣维欣、美诺恒康、步长制药。
CRO/CDMO包括:吉凯基因、吉玛基因、锐博生物、百奥迈科等。

图十六. 国内核酸药物公司
01、ASO药物
杭州天龙药业与中国人民解放军军事医学科学院产学研合作,开发了核心产品包括CT102、Cantide与Flutide等系列反以核酸候选药物,其中抗肝癌药物CT102获得临床试验批文。
2017年11月7日, 绿叶制药集团出资500万美元认购Exicure Inc.的股份,进入核酸药物领域,其三维球形核酸(SNA™)平台技术旨在充分发掘免疫调节和基因沉默药物在治疗各类器脏疾病的潜力。Exicure还获得了 世界知名投资大佬微软创始人比尔盖茨(Bill Gates)及同阶层富豪伙伴投资人的共同风险投资。

图十七. Exicure的研发管线
02、siRNA药物
国内siRNA药物龙头企业为苏州瑞博生物和苏州圣诺制药,其他还有舒泰神、西安荣清畅、绿叶制药、科伦药业、歌礼制药。2020年4月3日,瑞博生物获得4.7亿元人民币的C2轮融资,由中国国有资本风险投资基金、中金启德基金、高瓴创投联合领投,恒旭资本、朗玛峰创投、国药中金基金、深圳众汇、上海自贸区基金和弘陶资本等知名投资机构共同跟投完成。截至目前该公司已累计获超10亿元融资支持。

图十八. 瑞博生物研发管线
2019年4月圣诺制药完成4800万美元C轮融资,由华润正大生命科学基金、深圳旋石资本、瑞友资本、天际联想投资、华控基金、前海晟辉、越秀产业基金、仙瞳资本共同完成。公司产品STP705利用双靶标核酸抑制剂和多肽聚合物类纳米导入制剂,正在进行治疗非黑色素瘤皮肤癌的临床II期试验,此产品是与上市公司香雪制药联合开发,香雪制药作为合作伙伴共同拥有STP705用于增生性瘢痕治疗的中国权益。

图十九. 圣诺制药研发管线
舒泰神及全资子公司北京三诺佳邑于2019年09月19日收到了国家药品监督管理局签发的关于治疗乙型肝炎病毒感染相关疾病的siRNA药物,药品名称为STSG-0002注射液,通知书号CXSL1900065。
西安荣清畅利用tRNA支架在大肠杆菌中表达siRNA和miRNA等重组RNA,目前拥有在研siRNA药物4款,分别针对高胆固醇血症、年龄相关性黄斑变性、带状疱疹、骨肉瘤等适应症,均处于临床前研究阶段。
03、miRNA药物
国内昆山彭济凯丰生物科技、西安荣清畅均有布局miRNA药物,均处于早期研究阶段。彭济凯丰的1.1类治疗糖尿病肾病的miRNA新药研发项目于2018年获得国家重大新药创制科技重大专项立项支持。
04、saRNA药物
国内saRNA药物公司只有中美瑞康,有望填补现有靶向治疗药物只能抑制靶基因靶蛋白表达的巨大空白。中美瑞康由RNA激活领域的开拓者李龙承于2016年在中国江苏创立, 获得5000万元的风险投资。公司正在开发针对多个疾病领域的候选药物,以解决高度未满足的临床需求,当前产品处于临床前研究阶段。

图二十. 中美瑞康研发管线
05、mRNA药物
国内进入mRNA药物的公司有斯微生物、复星医药、美诺恒康。
斯微生物于2016年在上海张江成立,由美国MD Anderson肿瘤中心的博士团队归国创建,首次将mRNA药物及高端纳米制剂平台带入中国,研发涉及mRNA个体化癌症疫苗、mRNA传染病疫苗、蛋白缺陷类疾病mRNA药物和遗传病mRNA药物等产品。2019年7月完成了近亿元的A轮融资,投资方包括张江火炬创投、珠海隆门叁号、久友资本、芳华投资、龙磐投资。2020年1月完成A+轮3000万元融资,由君实生物和领承创投共同完成。

图二十一. 斯微生物研发管线
复星医药斥资约1.35亿美元与BioNTech达成COVID-19的mRNA疫苗合作,通过合作的方式进入mRNA药物领域。美诺恒康成立于2013年,以外包服务起家,随着肿瘤疫苗成为生物技术领域的新晋宠儿,美诺恒康转战肿瘤疫苗领域,着手研发mRNA肿瘤疫苗,近来美诺恒康的mRNA肿瘤疫苗便完成了概念验证。
06、DNA疫苗
艾棣维欣与Inovio Pharmaceuticals携手加快在中国开发INO-4800,INO-4800是Inovio针对冠状病毒株(2019-nCoV)的疫苗。艾棣维欣由此进入DNA疫苗领域。2020年3月,瑞普生物、鹏鹞环保等共计投资艾棣维欣3000万元。此前该公司由达晨创投和嘉兴星空完成A轮投资。
四
展望
2020年4月27日,Nature Reviews Drug Discovery杂志刊载了文章RNA therapeutics on the rise,向大家展示了已获批的几种核酸药物的销售情况:


图二十二. 代表性药物获批时间和销售额
经过多年的长跑,这些核酸药物已经取得了一定的成功,从开花到结果,吸引了不少资本的注意。技术的进步、产业链的健全、技术人才的回流、资本的支持,中国核酸药物将会成为下一个十年的风口。
引用资料
[1] RNAi: Therapeutic and Its Innovative Biotechnological Evolution. Biotechnology Advances. 2019, 37 (5): 801-825.[2] RNA therapeutics on the rise. Nature Reviews Drug Discovery. 2020. (doi: 10.1038/d41573-020-00078-0).[3] MicroRNA-based therapeutics in cardiovasculardisease: screening and delivery to the target. Biochemical Society Transactions. 2018, 46, 11–21.[4] 许从飞, 王均. 非编码RNA药物的研究进展. 生命科学. 2018, 30 (2): 213-221.[5] The challenge" and prospect of mRNA therapeutics landscape. The challenge" and prospect of mRNA therapeutics landscape. Biotechnol Adv. 2020. doi:10.1016/j.biotechadv.2020.107534.