模式识别受体(Pattern Recognition Receptor,PRR)
天然免疫系统检测微生物的存在,并启动防御机制以消除病原微生物。天然免疫系统利用了生殖系编码(Germline-encoded)的模式识别受体(Pattern Recognition Receptor,PRR),包括膜结合Toll样受体(TLRs)和RIG-I样受体(RLRs)等来检测外源病原体入侵。
微生物模式识别模型由Charles Janewayjr1989年提出,描述了天然免疫的两个特征:1.区分传染性非自身分子和自我分子的能力,2. 激活对传染性非自身分子的适应性免疫反应。Janeway之后,又有很多科学家发现,细菌,真菌,寄生虫,病毒,核酸等均能激活PRRs,诱导天然免疫。
大多数PRRs可根据蛋白质结构域同源性分为五个家族之一,这五个家族包括:Toll样受体(TLRs)、c型凝集素受体(CLRs)、核苷酸结合结构域、富含亮氨酸重复(LR R)的(或NOD样)受体(NLRs)、RIG-I-like受体(RLRs)和AIM2样受体(ALRs)。
表:模式识别受体

表:信号通路接头蛋白
天然免疫细胞生物学过程
PRRs的转运和天然免疫信号的定位可以调节信号转导,决定对于微生物的检测。
举例
TLR4转运至细胞质膜适当的位置,激活MyD88信号通路
CD14介导TLR4的内吞作用,从而导致来自内小体的TRIF依赖信号
RIG-I被转运到线粒体上MAVS信号传递的部位
线粒体的MAVS信号诱导I型和III型IFN反应,而过氧化物酶体的信号仅诱导III型IFN转录
Dectin信号可诱导吞噬,作为微生物清除的有效手段
NODS和TLRs将自噬调节因子招募到细菌进入区域,以消除病原体
自噬体可以传递细胞内病原体的抗原,用于MHC-II的递呈,以协调适应性免疫反应
炎症体激活导致一种快速形式的细胞死亡,称为细胞焦亡,这可以限制细胞内病原体的复制
RLR/MAVS信号通路也可诱导细胞死亡,限制病毒复制。
信号通路
TLRs是一种跨膜糖蛋白,包含细胞外结构域、跨膜结构域和细胞内TIR结构域。细胞外结构域负责配体识别,其特征是具有LRR模块的马蹄形结构。这些LRRs存在于细胞外结构域的内凹表面,它们在不同TLRs之间的变化被认为提供了配体特异性。
TLRs通过招募不同的接头蛋白传递信号,部分解释转录结果的差异。
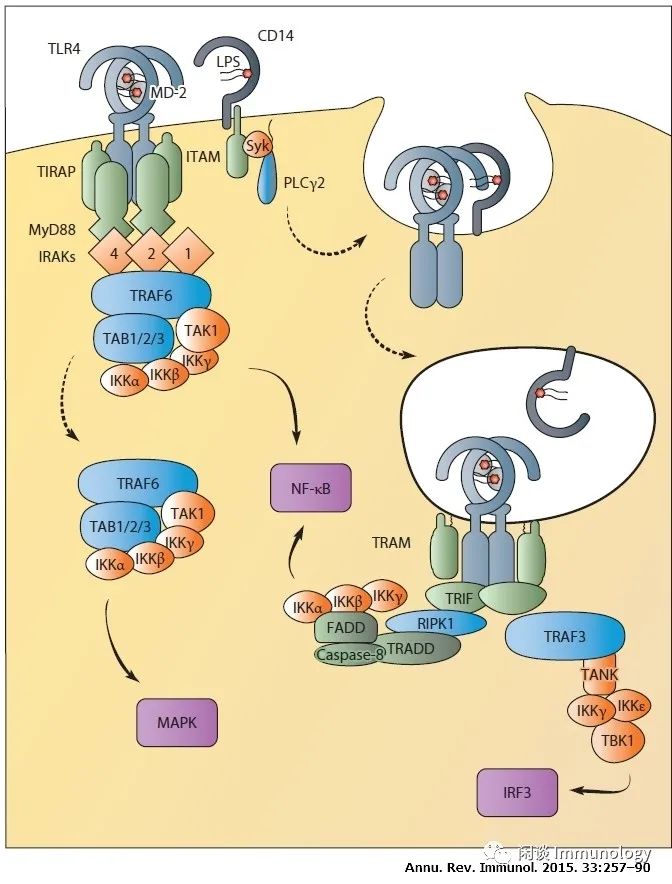
1. TLR4,MD-2, CD14, LBP:脂多糖-多重受体复合物
作为TLR家族的原型,TLR4是第一个在功能上被表征的成员,是唯一在信号中使用所有四种接头蛋白的TLR。
2.来自质膜的TLR4信号转导
来自质膜和内小体的TLR4信号。TLR4需要易位到富含TiRAP的脂筏,以便从质膜传递信号。这有利于与MyD88在配体结合上的相互作用,从而形成含有MyD88、TIRAP和IRAKs的MyDD小体。这些IRAKs招募E3泛素连接酶TRAF6,它与由TAB1,TAB2,TAB3和TAK1形成的复合物相互作用。这种复合物通过IKKs调节NF-κB的激活。
释放细胞质的TAK1诱导MAPK的激活。CD14通过激活ITAM、Syk和PLCγ2,控制TLR4从质膜进入内小体的运动。从内小体中,TLR4与选择的接头蛋白TRAM与信号通路接头蛋白TRIF相互作用,以维持NF-κB激活,并诱导IRF3介导的I型IFN产生。
依赖TRIF的NF-κB激活可能通过蛋白质RIPK1、TRADD和Caspase-8复合物进行。IR F3激活控制I型IFN的生产,需要将TRAF3招募到TRIF,然后TRAF3与TANK(或TANK相关蛋白)相互作用,以招募IKKγ、IKKε和TBK1,激活IRF3。
3.Dectins信号通路
Dectin-1信号控制NF-κB和NF-AT的激活。在配体结合时,Dectin-1的Hemitam结构域被Src家族激酶(SFKS)磷酸化,后者招募信号激酶Syk。这需要将磷酸酶CD45和CD148远离形成的吞噬体。Syk激活可控制PLCγ2活性,诱导IP3和DAG的形成。IP3介导Ca2+从内质网释放,可诱导CRAC依赖的Ca2+内流和随后的NFAT激活。Ca2+和DAG调节PKCδ激活,诱导CARD9/Bcl-10/Malt-1复合物后,它控制典型的NF-κB激活。同时,Syk还通过Nik控制非规范的NF-κB激活
4.来自内小体的天然免疫信号
1. NOD受体与内体膜结合,在那里它们被定位,可与PAMPS相遇。当微生物从内小体中逃逸,或者它们被转运蛋白如SLC15A3泵出。NOD信号激活RIPK2,通过NF-κB和MAPK激活,触发促炎细胞因子的产生。
2. 与TLR4不同,TLR3不需要接头蛋白TRAM,但它也可以类似地激活IRF3来产生I型IFN和ISGs,以及激活NF-κB以产生促炎细胞因子。
3. 其他内小体TLRs主要通过接头蛋白MyD88和TIRAP激活NF-κB。在pDC中,TLR7和TLR9通过激活IRF7触发IFN和ISGs的产生。
5.生物合成途径:识别胞浆内核酸
RLRs检测胞浆内病原体衍生RNA,诱导IFN和促炎细胞因子的产生。TBK1、IKK和MAVS途径导致转录因子的激活,从而诱导IFN和其他细胞因子基因。
A.RIG-I信号转导受TRIM25和RIPLET介导的泛素化和14-3-3ε易位到信号传递部位的调控。MAVS的活性受聚合的调节,线粒体的信号导致I型和III型IFN的产生,而过氧化物酶体信号仅诱导III型IFN的产生。
B.CGAs和ALRs从胞浆和细胞核内检测病原体来源的DNA,以诱导IFN的产生
在DNA存在下,CGAs酶将ATP和GTP转化为环二核苷酸cGAMP。cGAMP的产生以ATG9和VSP34依赖的方式诱导STING的激活和转运到定义不明确的信号传递位点。将TBK1招募到该信号站点,以诱导I型IFN的产生。
细胞核内的病毒DNA可以通过IFI16检测,产生I型IFN。因此,这种受体或另一种因子从细胞核转运到胞浆可能调节IFI16依赖的信号。
C.炎症介导的对胞浆内DNA反应,AIM2检测胞质DNA,激活炎症小体的形成,诱导细胞死亡和IL-1β的成熟,这种细胞因子的分泌需要一种不受内质网和高尔基体转运的非典型途径。已经提出了几种可能性的IL-1β释放,包括通过溶酶体室,多囊体或孔隙产生的细胞焦亡。
喵评:先天免疫/天然免疫/固有免疫的核心突破是模式识别的发现,人类通过不同的模式识别受体,实现对于微生物,损伤,毒品等有害性刺激的精准识别和免疫应答。
参考文献
Janeway CA. 1989. Approaching theasymptote? Evolution and revolution in immunology. Cold Spring Harb. Symp.Quant. Biol. 54(Pt. 1):1–13
SkyW. Brubaker et al,Innate Immune Pattern Recognition: ACell Biological Perspective,Annu. Rev. Immunol. 2015. 33:257–90