T细胞亚群及表型特征影响
细胞毒性CD8+CART细胞,直接介导肿瘤细胞清除,但是CD4+辅助细胞(Th细胞)同样有着重要作用。CD4+和CD8+CART应该有一个合适的比例,有报道,治疗B-ALL中,1:1会获得产生更好的肿瘤消退疗效(3)。
调节性T细胞浸润到实体肿瘤局部,会降低CD28-CD3ζ信号通路活性。去除CD28CAR胞内段的Lck结合结构域,即使在调节性T细胞存在的情况下,也有强抗肿瘤活性(4)。
低分化的初始样T细胞(naïve-like T cells ,T N cells,表型CD45RA+ CD45RO- CD95-,CCR7+,CD62L+,CD28+,CD27+)和干细胞记忆样T细胞(Stem cell memory-like T cells ,T SCM cells,表型CD45RA+ CD45RO- CCR7+CD95+)具有更强的增殖能力和自我更新能力,以及分化为效应和记忆T细胞的能力,因而有产生更好临床结果的潜能,更持久的抗肿瘤活性。
而分化的效应样T细胞(T effector-like cells,TEff cells,表型CD45RA+ CCR7-)虽然体外表现初强的抗肿瘤活性,但是在体内,活化和增殖等能力均受损。
肿瘤高表达免疫检查点配体,免疫细胞高表达免疫检查点受体,则病人对于CART缺乏应答。
T细胞需要表达淋巴组织归巢分子(CCR7和CD62L),有助于浸润到肿瘤局部,起到更好的治疗效果。如上文,T N 和T SCM 表达归巢受体,而T eff 不表达归巢受体。 高表达CXCR2和GD2也有助于CAR-T浸润到肿瘤组织。
生产工艺及优化
1. 细胞分离和富集
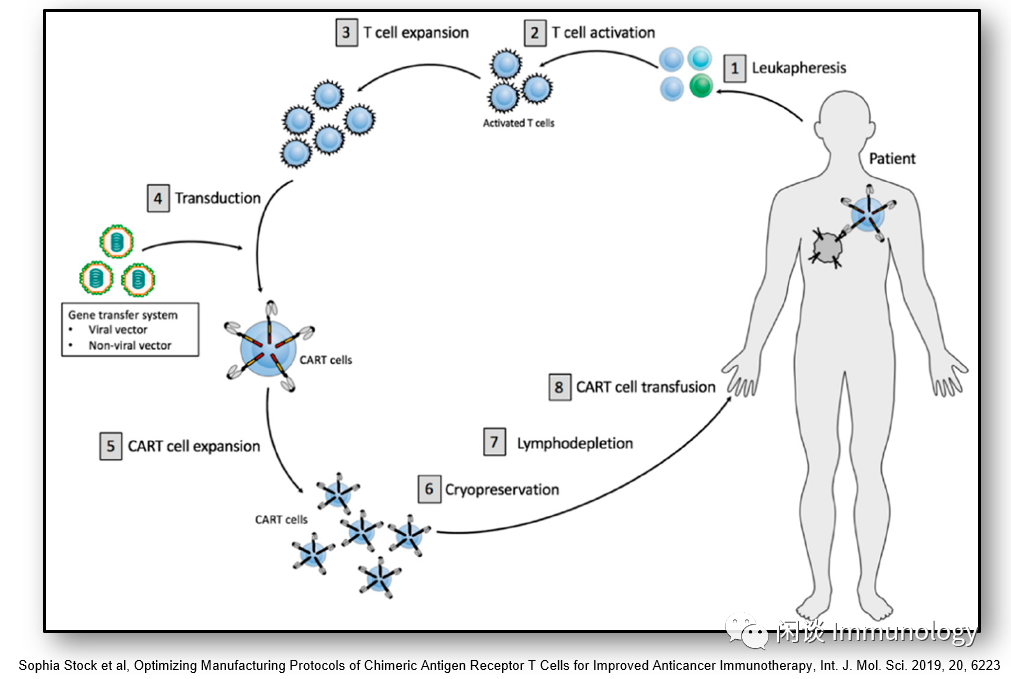
分离方法:传统方法Ficoll密度梯度离心用于去除颗粒细胞、红细胞和血小板;自动化的分离系统:Sefia Cell Processing System,CliniMACS Prodigy。
基于CD3+进行细胞分选,然后以磁珠为基础的技术如CliniMACS Prodigy,使用anti-CD3,anti-CD4,anti-CD8磁珠分选或者去除特定的细胞群,以获得合理比例的CD4:CD8。
特定未分化的T N ,T SCM ,T CM 细胞对于临床是有益的(7),但是分选流程复杂,在实际生产流程中有一定困难。
2. T细胞激活
2.1anti-CD3/anti-CD28抗体活化
使用抗CD3(OKT-3单克隆抗体)/抗CD28抗体包被磁珠作为人工抗原提呈颗粒,anti-CD3提供增殖信号,anti-CD28提供共刺激信号。活化之后,磁珠可被磁铁去除掉。
和可溶性OKT-3抗体相比,抗体包被磁珠活化细胞,具有更少的分化,更少衰老的特点。另外富集和清洗细胞会更加简单,昂贵抗体的丢失更少。因而磁珠法是生产工艺中最常用的方法,如诺华的Kymriah。
最近一种特殊的聚合物纳米基体产品(T Cell TransAct),上面结合有人源化CD3和CD28抗体,结合使用无血清培养基(TexMACS),用于T细胞活化。这种方法增加了高表达CD62L,CCR7的 T CM 细胞,减少CD57+耗竭T细胞,但是不改变PD-1的表达和基因转染效率,而且细胞裂解活性降低(8)。
2.2 Retronectin
Retronectin是另外一种活化策略,使用重组纤维连接片段,同时可以增加逆转录病毒的感染效率。Retronectin和板结合CD3抗体,或者anti-CD3/anti-CD28磁珠,用于GD2特异性CART和CD19特异性CART(9),增加T N 和T SCM 的比例。但是T细胞活化弱,扩增弱,细胞因子分泌少等是缺点。
2.3 人工APC细胞
人工APC递呈TAA给CART,使其活化。比如使用K-562同时表达TAA和共刺激分子,不表达HLA-A,HLA-B,仅可用于TAA特异性CART活化(10)。
3. 基因转导系统
3.1病毒转导
病毒转染系统转染效率高,最常用的是逆转录病毒载体和慢病毒载体。逆转录病毒将病毒DNA整合到宿主DNA中,产生稳定的转染。慢病毒需要调节基因来中和宿主细胞的防御,削弱免疫反应,以及调节病毒复制。慢病毒载体,插入诱变和致癌的风险很低。
逆转录病毒生产需要大量的包装细胞,而慢病毒载体生产需要大量质粒DAN进行瞬时转染。病毒的生产需要GMP级别的生产车间和一系列的检测方法,是病毒转染细胞最大瓶颈。
诺华的Kymriah® (Tisagenlecleucel)和 施贵宝Lisocabtagene maraleucel (liso-cel; JCAR017)均使用慢病毒载体。Kite Yescarta (axicabtagene ciloleucel) 使用逆转录病毒。
3.2 基于质粒的基因传递
转座子/转座酶系统是一种替代的非病毒基因传递策略。采用“睡美人”转座子/转座酶系统进行CART制造。该系统由两个DNA质粒组成,一个编码CAR,第二表达转座酶,这是切除和插入转基因所必需的。这种方法不需要GMP车间生产病毒,成本低。在第一代CART和第三代CART中被使用,产品已经开始在临床实验中使用。
3.3 基因编辑
CRISPR/Cas9能够特异性地破坏多个基因的基因组基因座。CRISPR/Cas9系统结合腺相关病毒(AAV)载体,将CAR的DNA整合入T细胞受体a,提高T细胞效力,抑制T细胞分化和衰竭。使用基因编辑和慢病毒转导,用于产生PD-1缺陷的CD19特异性CART,增强抗肿瘤活性。
4. CART细胞结构
CAR结构包含
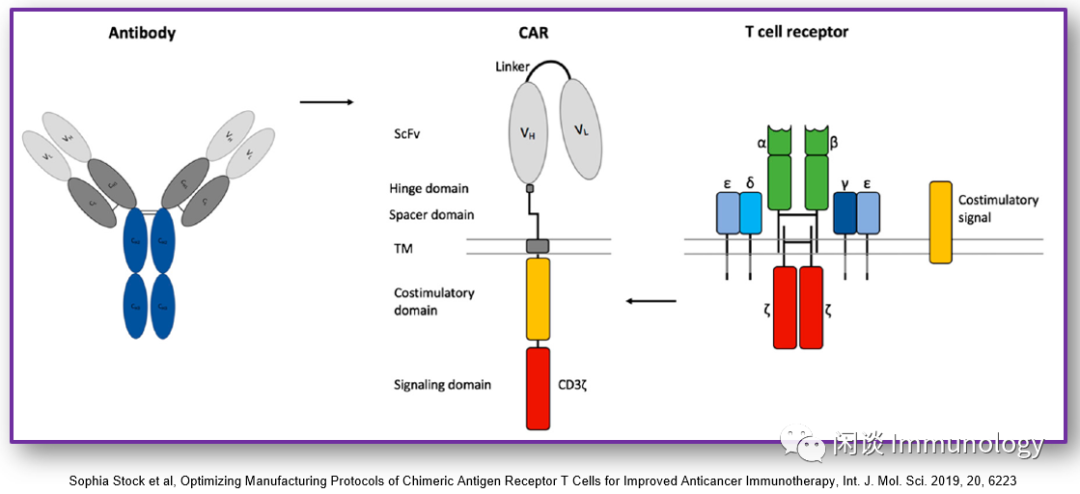
抗体的单链可变区(scFv)
非信号胞外区
与scFv链接的铰链区
跨膜区
T细胞受体胞内CD3ζ区
共刺激因子结构域
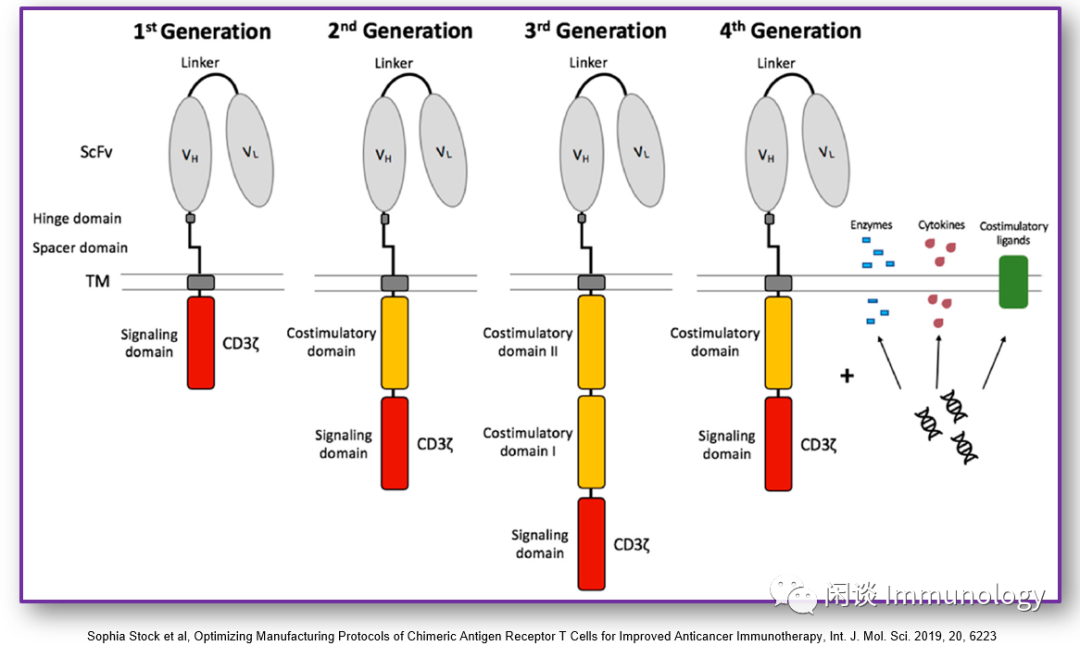
四代CAR的发展
第一代CART诱导T细胞激活仅通过cd3ζ信号域激活
第二代CART中增加了共刺激结构域
第三代CART增加两个共刺激结构域
第四代CART增加酶、细胞因子和共刺激配体
5. T细胞扩增
在CART细胞扩增过程中,细胞数量不断增加,培养基体积增大,必须通过更多或更大的组织培养瓶,这极大地复杂化了制造过程,并且它无法实现大规模的生产。
静态培养袋,允许较少的手动开放处理,管道连接可以使其在无菌条件下进行。
另一种方法 使用生物反应器,如Xuri细胞扩增系统和Wave生物反应器系统,利用灌注机制添加营养物质以及去除生长抑制物质,从而简化了制造过程。
6. 细胞因子刺激
细胞因子在工艺中使用,作为刺激信号,对于CART细胞质量,表型等产生重要影响。主要是γ链细胞因子:IL-2, IL-4, IL-7, IL-9, IL-15, IL-21。常用IL-2 或者IL-7,同时使用/或者不适用IL-15.
诺华Yescarta使用IL-2,但是IL-2会导致分化和耗竭的T细胞表型。IL-7/IL-15可以增强T细胞活化和增殖,二者联合使用可以增加未分化CART(T N ,T SCM) 的存活和维持。单独添加IL-15也会增加耗竭表型,及抗凋亡活性。
和IL-2和IL-15比较,IL-21可以增加CD62L表达,增加抗肿瘤活性(15)。
7. 抑制特定的信号通路
主要靶向GSK3β, mTOR, AKT, 和PI3K:
GSK3β阻断T细胞分化,产生更多的TSCM
mTOR inhibitor rapamycin增加CD62L表达
体外AKT抑制剂也表现出增加T细胞抗肿瘤活性(16)
PI3K抑制剂idelalisib,降低调节性T细胞,逆转肿瘤免疫耐受,增加低分化CART细胞数量(18)
8. 冷冻保存
冷冻保存CART细胞长达90天,不影响细胞的活力。使用前37℃过夜,可以恢复CART细胞活力(17)。
喵评:免疫细胞治疗的工艺随着大家对于免疫系统的深入研究,将来还会有更多的优化。
主要参考文献
Wang, D.; Aguilar, B.; Starr, R.; Alizadeh, D.; Brito, A.; Sarkissian, A.; Ostberg, J.R.; Forman, S.J.; Brown, C.E. Glioblastoma-targeted CD4+ CAR T cells mediate superior antitumor activity. JCI Insight 2018, 3.
Yang, Y.; Kohler, M.E.; Chien, C.D.; Sauter, C.T.; Jacoby, E.; Yan, C.; Hu, Y.; Wanhainen, K.; Qin, H.; Fry, T.J. TCR engagement negatively affects CD8 but not CD4 CAR T cell expansion and leukemic clearance. Sci. Transl. Med. 2017, 9.
Turtle, C.J.; Hanafi, L.A.; Berger, C.; Gooley, T.A.; Cherian, S.; Hudecek, M.; Sommermeyer, D.; Melville, K.; Pender, B.; Budiarto, T.M.; et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. J. Clin. Investig. 2016, 126, 2123–2138.
Kofler, D.M.; Chmielewski, M.; Rappl, G.; Hombach, A.; Riet, T.; Schmidt, A.; Hombach, A.A.;Wendtner, C.M.;Abken, H. CD28 costimulation Impairs the ecacy of a redirected t-cell antitumor attack in the presence of regulatory t cells which can be overcome by preventing Lck activation. Mol. Ther. 2011, 19, 760–767.
Busch, D.H.; Frassle, S.P.; Sommermeyer, D.; Buchholz, V.R.; Riddell, S.R. Role of memory T cell subsets for adoptive immunotherapy. Semin. Immunol. 2016, 28, 28–34
Sophia Stock et al, Optimizing Manufacturing Protocols of Chimeric Antigen Receptor T Cells for Improved Anticancer Immunotherapy, Int. J. Mol. Sci. 2019, 20, 6223
Wang, X.; Naranjo, A.; Brown, C.E.; Bautista, C.; Wong, C.W.; Chang, W.C.; Aguilar, B.; Ostberg, J.R.; Riddell, S.R.; Forman, S.J.; et al. Phenotypic and functional attributes of lentivirus-modified CD19-specific human CD8+ central memory T cells manufactured at clinical scale. J. Immunother. 2012, 35, 689–701.
Gargett, T.; Truong, N.; Ebert, L.M.; Yu, W.; Brown, M.P. Optimization of manufacturing conditions for chimeric antigen receptor T cells to favor cells with a central memory phenotype. Cytotherapy 2019, 21, 593–602
Stock, S.; Homann, J.M.; Schubert, M.L.;Wang, L.;Wang, S.; Gong,W.; Neuber, B.; Gern, U.; Schmitt, A.; Muller-Tidow, C.; et al. Influence of Retronectin-Mediated T-Cell Activation on Expansion and Phenotype of CD19-Specific Chimeric Antigen Receptor T Cells. Hum. Gene Ther. 2018, 29, 1167–1182.
Singh, H.; Figliola, M.J.; Dawson, M.J.; Olivares, S.; Zhang, L.; Yang, G.; Maiti, S.; Manuri, P.; Senyukov, V.; Jena, B.; et al. Manufacture of clinical-grade CD19-specific T cells stably expressing chimeric antigen receptor using Sleeping Beauty system and artificial antigen presenting cells. PLoS ONE 2013, 8, e64138
Levine, B.L. Performance-enhancing drugs: Design and production of redirected chimeric antigen receptor (CAR) T cells. Cancer Gene Ther. 2015, 22, 79–84
Kebriaei, P.; Singh, H.; Huls, M.H.; Figliola, M.J.; Bassett, R.; Olivares, S.; Jena, B.; Dawson, M.J.; Kumaresan, P.R.; Su, S.; et al. Phase I trials using Sleeping Beauty to generate CD19-specific CAR T cells. J. Clin. Investig. 2016, 126, 3363–3376
Eyquem, J.; Mansilla-Soto, J.; Giavridis, T.; van der Stegen, S.J.; Hamieh, M.; Cunanan, K.M.; Odak, A.;Gonen, M.; Sadelain, M. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 2017, 543, 113–117
Rupp, L.J.; Schumann, K.; Roybal, K.T.; Gate, R.E.; Ye, C.J.; Lim,W.A.; Marson, A. CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor ecacy of human chimeric antigen receptor T cells. Sci. Rep. 2017, 7,737.
Hinrichs, C.S.; Spolski, R.; Paulos, C.M.; Gattinoni, L.; Kerstann, K.W.; Palmer, D.C.; Klebano, C.A.;Rosenberg, S.A.; Leonard,W.J.; Restifo, N.P. IL-2 and IL-21 confer opposing dierentiation programs to CD8+T cells for adoptive immunotherapy. Blood 2008, 111, 5326–5333
Crompton, J.G.; Sukumar, M.; Roychoudhuri, R.; Clever, D.; Gros, A.; Eil, R.L.; Tran, E.; Hanada, K.; Yu, Z.;Palmer, D.C.; et al. Akt inhibition enhances expansion of potent tumor-specific lymphocytes with memory cell characteristics. Cancer Res. 2015, 75, 296–305
Panch, S.R.; Srivastava, S.K.; Elavia, N.; McManus, A.; Liu, S.; Jin, P.; Highfill, S.L.; Li, X.; Dagur, P.;
Kochenderfer, J.N.; et al. Eect of Cryopreservation on Autologous Chimeric Antigen Receptor T Cell Characteristics. Mol. Ther. 2019, 27, 1275–1285
Bowers, J.S.; Majchrzak, K.; Nelson, M.H.; Aksoy, B.A.; Wyatt, M.M.; Smith, A.S.; Bailey, S.R.; Neal, L.R.; Hammerbacher, J.E.; Paulos, C.M. PI3Kdelta Inhibition Enhances the Antitumor Fitness of Adoptively Transferred CD8+ T Cells. Front. Immunol. 2017, 8, 1221