炎症小体
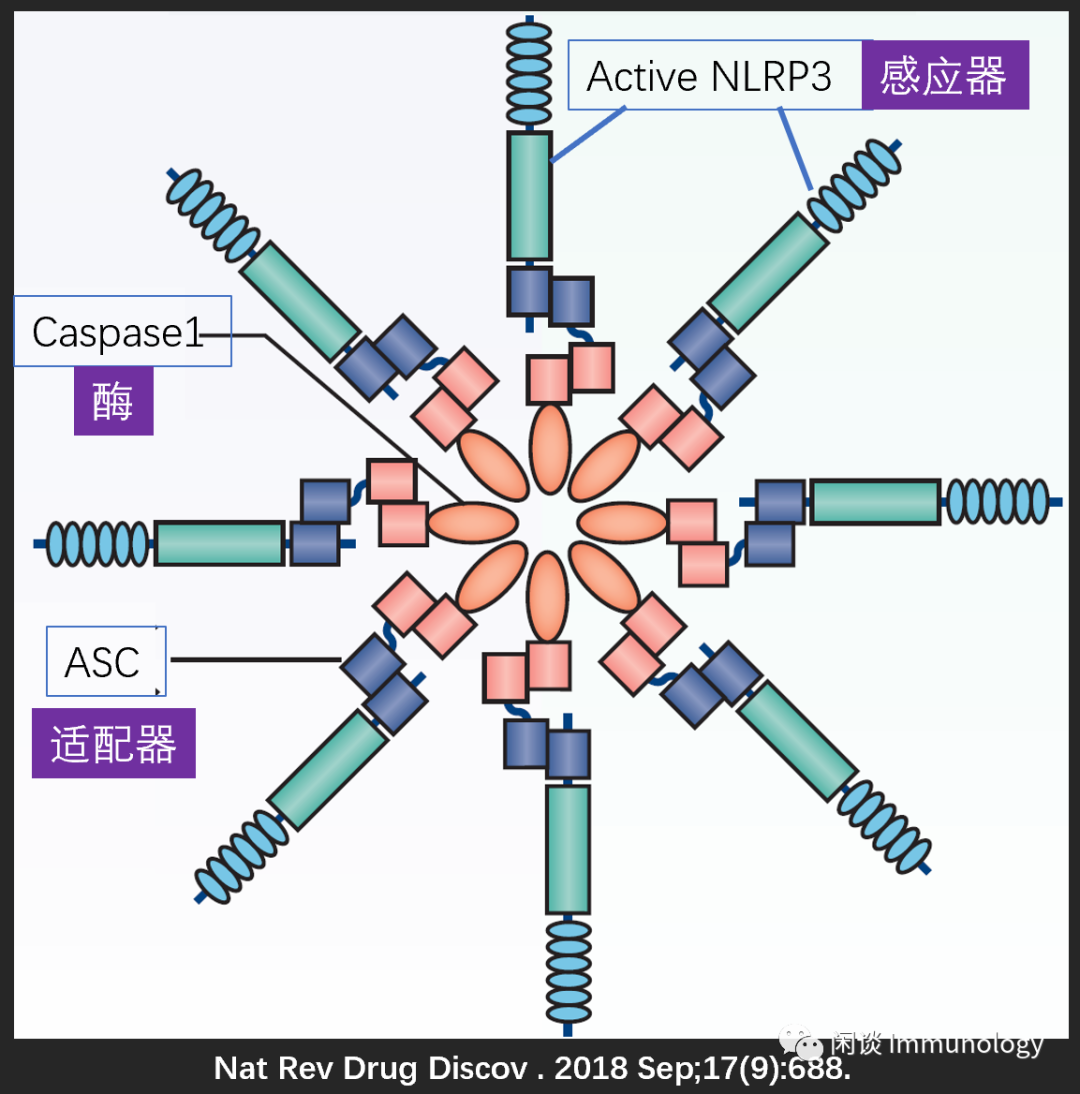
炎症小体(Inflammasome)是由感应器、适配器和酶原Proaspase-1组成的多聚蛋白复合物。
炎症小体的组装是天然免疫细胞对病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)的反应。
炎性小体通过引起Caspase-1自我剪切,活化,进而裂解Pro-IL-1β,Pro-IL-18,形成成熟IL-1β,IL-18.
活化的caspase-1也能裂解GasderminD,从而导致一种特殊的细胞死亡,称为细胞焦亡(pyroptosis)。
常见感应器蛋白:NLRP1,NLRP3,NLRP6,NLRP12,NLRC4,AIM2,Pyrin等。
炎症小体组装
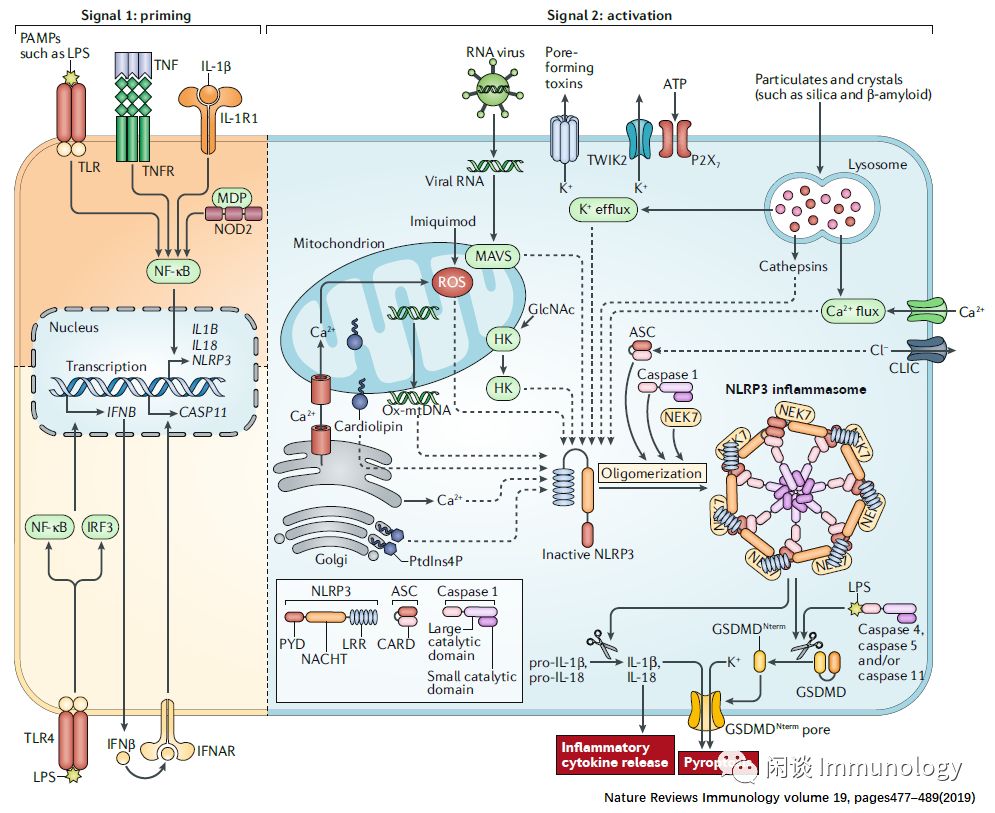
两步完成NLRP3炎性小体组装:初始化,激活组装。如下图:
1. 初始化:激活细胞因子或病原体相关分子模式(PAMPs)提供信号,炎症小体成分转录上调。
2. 激活组装:任何数量的DAMPs和PAMPs,激活上游事件。RNA病毒通过线粒体外膜线粒体抗病毒信号蛋白(MAVS)激活NLRP3。炎症小体的形成激活caspase1,而caspase1又切割pro-IL-1β和pro-IL-18。GSDMD也被剪切并插入到膜中,形成孔隙并诱导焦亡。
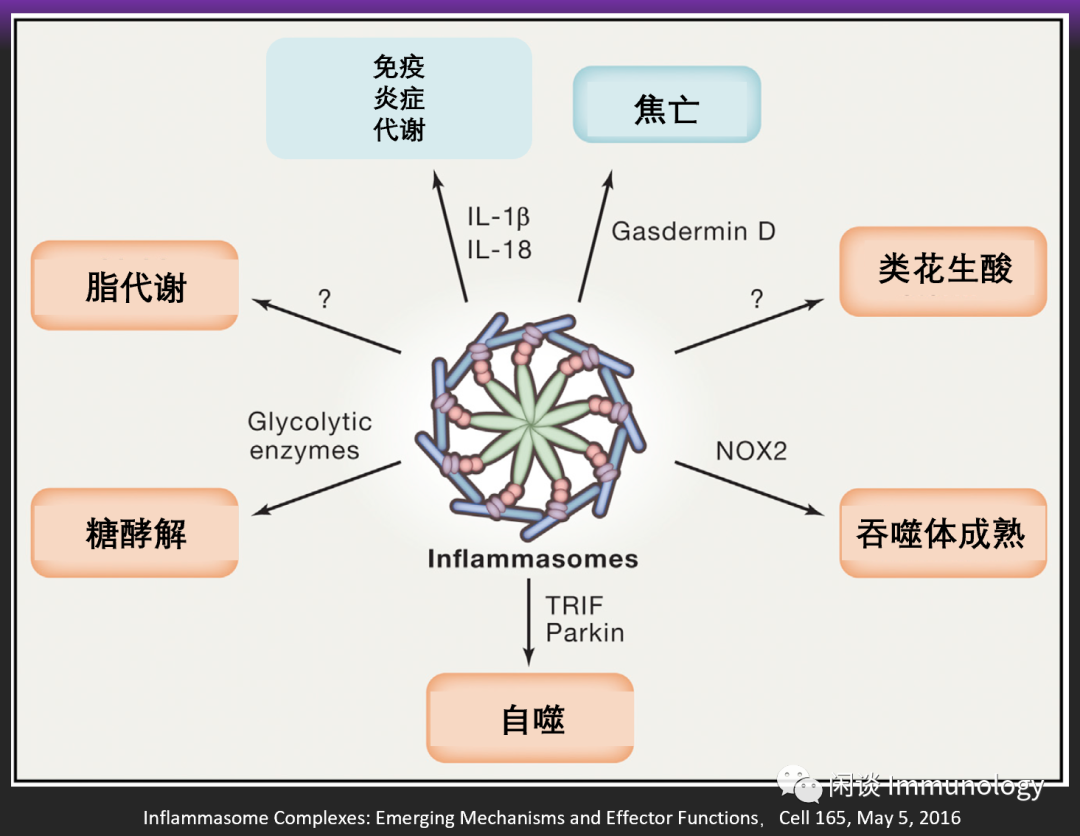
炎症小体的生物学作用
除了参与炎症,凋亡。炎症小体还参与了多种生物学行为。
炎症小体与自身免疫性疾病和炎症性疾病
自身免疫性疾病
炎性小体由初始化和活化信号组成。病原体相关分子模式(PAMPs)或内源性损伤相关分子模式(DAMPs),导致TLRs和NFκB激活,介导NLRP3炎性小体形成。功能性NLRP3炎性小体由钾外排、ROS产生、溶酶体破裂、线粒体应激等多种二次信号形成。AIM2感知dsDNA。最后,在NLRP3或AIM2炎性小体的平台上产生caspase1、IL-1β、IL-18,进而活化初始T细胞,分化为Th1和Th17,分泌细胞因子,诱发自身免疫性疾病。
炎症性疾病
炎症小体参与了多种炎症性疾病
靶向炎症小体的药物
靶向药物的机理
具体药物列表
参考文献
Karen V. Swanson,The NLRP3 inflammasome:molecular activation and regulation to therapeutics,Nature Reviews Immunology volume 19, pages477–489(2019)
Vijay A.K. Rathinam et al,Inflammasome Complexes: Emerging Mechanisms and Effector Functions,Cell 165, May 5, 2016
Ankit Malik,Inflammasome activation and assembly at a glance,Journal of Cell Science (2017) 130, 3955-3963
Carmen Venegas,Inflammasome-mediated innate immunity in Alzheimer’s disease,FASEB J. 33, 000–000 (2019).
Ayesha Zahid,Pharmacological Inhibitors of the NLRP3 Inflammasome,Front. Immunol. 10:2538.
Jae Il Shina,Inflammasomes and autoimmune and rheumatic diseases: A comprehensive review,Journal of Autoimmunity 103 (2019) 102299
Matthew S. J. Mangan et al, Targeting the NLRP3 inflammasome in inflammatory diseases,Nat Rev Drug Discov . 2018 Sep;17(9):688.