皮肤是人体最大的器官,也是人体的第一道屏障,不仅起到物理防御的作用,还有免疫、代谢和紫外线防护功能[1-2]。由于皮肤具有较大的接触面积,可以对化合物进行有效的、选择性渗透,使得皮肤成为颇受关注的给药途径。
根据药物在皮肤上的应用和目的可以分为表皮给药、真皮给药和经皮给药。
表皮和真皮给药均为局部起效的外用制剂,针对发病部位的不同,通过渗透作用到达不同的皮层,发挥治疗效果。剂型包括溶液、乳液、凝胶、药膏、药贴和泡沫。治疗领域包括细菌感染、真菌或酵母菌感染、病毒感染、瘙痒、痤疮等。这类局部外用制剂其渗透过程多为被动吸收过程。通常情况下药物不被吸收入血,因此其在血液中的暴露量通常极低,不易被检测到。并且局部皮肤用药的系统暴露量一般来说与药效没有直接关系,因此基于血液中暴露量的药代动力学研究方法一般不适用于局部皮肤用药的生物等效性研究[3]。
本文仅讨论局部给药后全身起效的经皮给药制剂,局部起效的表皮给药和真皮给药等外用制剂不在讨论范围内。
一、经皮给药系统
经皮给药系统又称为透皮给药系统或透皮治疗系统(Transdermal drug delivery systems,TDDS),系指药物由皮肤吸收进入全身血液循环并达到有效血药浓度,实现经临床批准的疾病治疗或预防的目的。它是仅次于口服和注射的第三大给药系统[4-7],是口服药物和皮下注射的一种方便的替代方法。经皮给药系统是一种局部给药,一般指经皮给药的新剂型,即皮肤贴片。通过贴片的形式以预定和可控的速度给药,以产生全身效应。
经皮给药是一种前瞻性的给药策略,以弥补传统给药系统,包括口服和注射方法的局限性。这种非侵入性的给药途径既方便又具有缓释作用(适用于生物半衰期短,需要频繁口服或非肠道给药的药物),可减少给药次数,延长给药时间,也可用于睡眠、反应迟钝或无法吞咽口服药物的患者,如果需要,可随时取出药物以停止给药,大大提高了患者的依从性;还可以降低血药浓度的波动和毒副作用[8-10];更重要的是,还可避免肝脏的首过效应,从而防止药物在胃肠道中被破坏[11-12],提高了药物的生物利用度。但该系统也存在局限性,起效慢、效率低,而且大面积给药,可能会对皮肤产生刺激性和过敏性;同时皮肤的屏障作用也影响了药物的吸收和转运。
由于皮肤的屏障作用,限制了药物经皮吸收速率,使得经皮给药制剂表现出独特的药代动力学特点。因此,本文将从皮肤主要解剖结构及基本特性、药物的经皮吸收过程、经皮给药药物、动力学模型以及生物分析实例等几个方面进行简述,以期阐明经皮给药制剂的药代动力学和生物分析特点。
二、皮肤解剖结构及基本特性
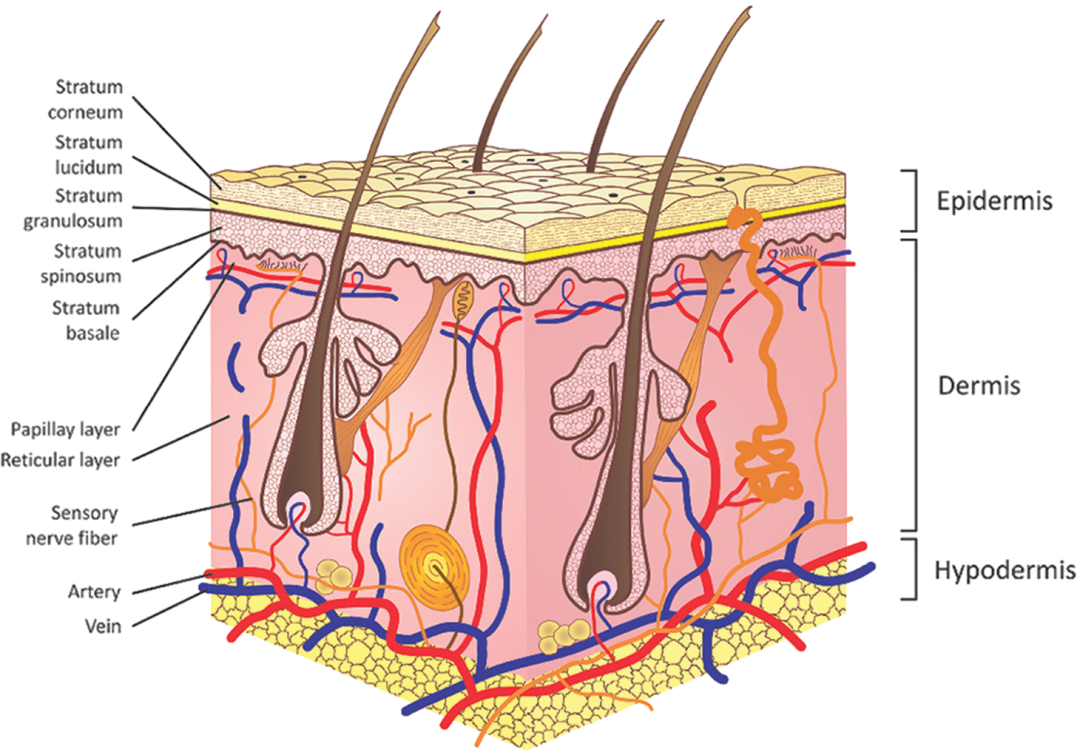
了解皮肤的结构及基本特性对于理解经皮给药系统至关重要。皮肤是一个独特的生理屏障,由外到内分为三层:表皮层、真皮层和皮下层,还包括一些附属物,如毛囊、汗腺和皮脂腺。表皮层和真皮层对药物经皮吸收的影响较为关键。
1. 表皮
表皮是皮肤的最外层,平均厚度为0.2 mm,是身体内部与外部环境之间的物理和化学屏障。表皮为层状鳞状上皮,由外向内分别是角质层和活性表皮层。
1.1 角质层
最外层的角质层承担着皮肤的主要屏障功能[13-14] ,是分子、药物或生物大分子经皮转运的最主要障碍[17]。角质层由10~25层分化的、无核的角质细胞和细胞间质组成,含有40%的脂质、40%的蛋白质和20%的水[16],具有防止皮肤深层水分流失和有害化学物质入侵的功能[15]。
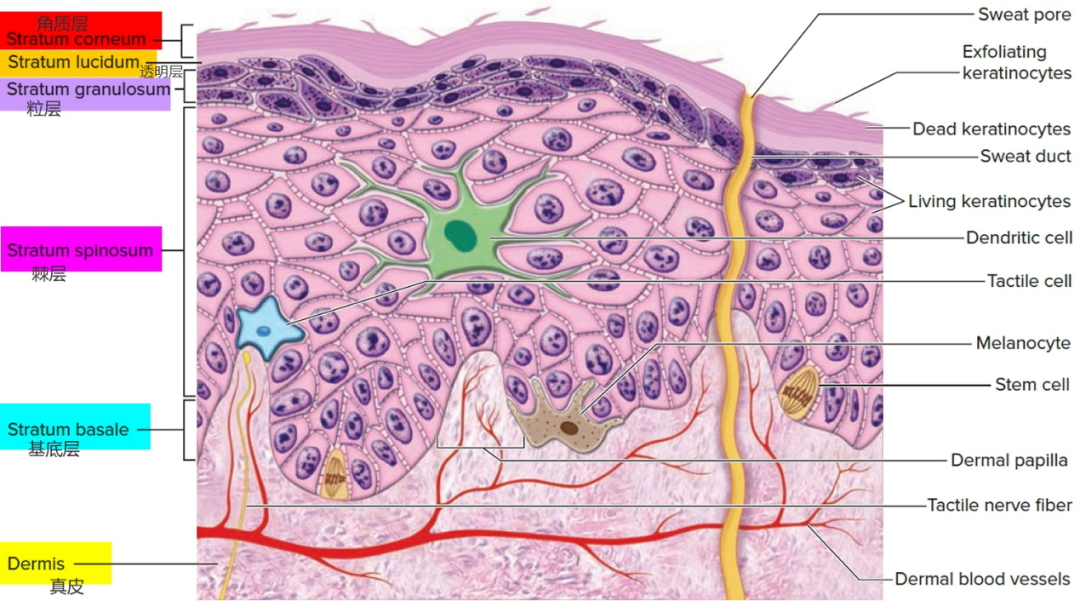
图1 表皮的结构[18]
1.2 活性表皮层
活性表皮层是药物结合、代谢、活性转运和监测的区域,由外向内又分为透明层、粒层、棘层、基底层。主要由不同角质化程度的角质形成细胞组成,还包括黑色素细胞、Merkel细胞、Langerhans细胞等[19]。
2.真皮
真皮是皮肤的中间层,是皮肤的深层结构支撑,约3~5 mm厚,主要由胶原蛋白和弹性蛋白组成。真皮层有纤维细胞、单核吞噬细胞、淋巴细胞,而且大量的血管、毛细淋巴管网络、毛囊、感觉神经末梢、皮脂腺和汗腺也在这一层[20]。真皮层主要发挥免疫防御、调节感觉等作用,是药物的主要吸收部位。
3.皮下层
皮下层是皮肤的最内层,由疏松的结缔组织网状结构组成,连接真皮与肌肉或骨骼[21],是脂肪的重要储存部位。皮下脂肪组织内也有血管及汗腺,可作为脂溶性药物的贮库。
4.皮肤附属器
皮肤附属器主要是指毛囊、汗腺、皮脂腺等。汗腺导管贯穿真皮与表皮,开口于皮肤表面。
图2 皮肤层的示意图[22]
三、药物经皮吸收过程
经皮给药制剂的药代动力学研究在TDDS研发和临床治疗上发挥重要的作用。经皮给药制剂通过皮肤吸入后进入体循环,其分布、代谢、排泄均与其靶器官相关,种类繁多,因此本文仅对经皮吸收过程进行介绍。
1.吸收过程
由于表皮层内无血液循环系统,其营养物质供给及新陈代谢主要靠真皮内的组织液来回穿越基底膜进行,所以药物渗透入表皮层中无法通过血管产生吸收作用。而真皮及皮下组织对药物穿透的阻力小,药物进入真皮及皮下组织后易为血管及淋巴管所吸收。
从应用于皮肤表面的TDDS释放药物并将其转运到体循环涉及以下步骤:1)药物溶解并从TDDS中释放;2)分布到皮肤的最外层角质层;3)通过角质层扩散;4)从角质层分布到水性的活性表皮层;5)通过活性表皮层扩散到真皮层的上部;6)吸收入局部毛细血管网,并最终进入体循环。
图3 多层皮肤模型,显示药物经皮渗透至体循环的顺序[16]
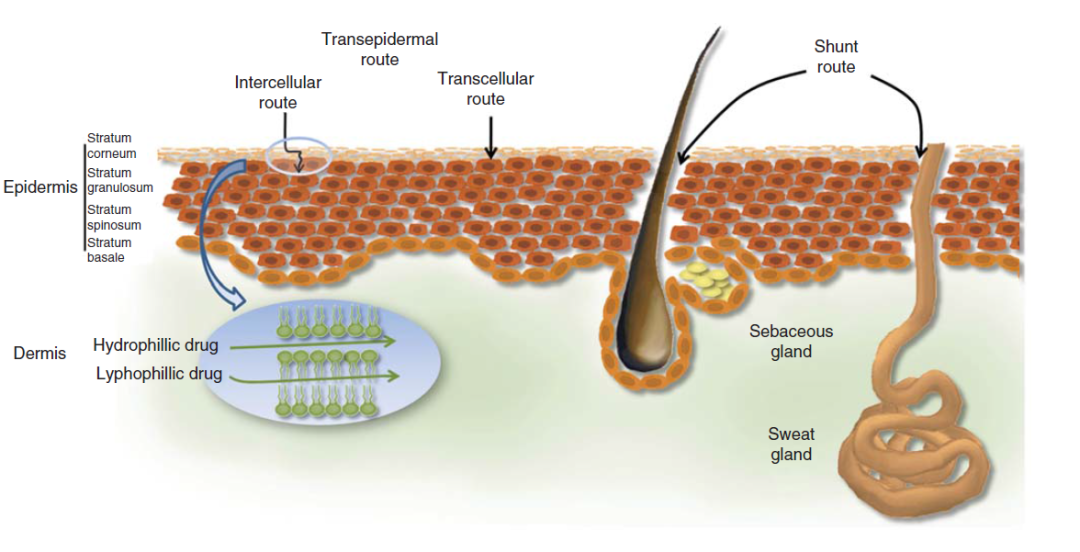
药物渗透入皮肤主要通过跨细胞通路、细胞间通路、皮肤附属器通路这三种途径,以皮肤表面与皮肤深层的药物浓度差为动力进行被动扩散。药物渗透的这三种途径是经皮渗透吸收的最基本方式。药物通过这些途径的组合渗透过皮肤,每个途径渗透的药物的量取决于其物理化学性质。
图4 经皮渗透途径 [23]
(1)跨细胞通路(Transcellular route)、
药物可以通过跨细胞通路穿过角质细胞而进入皮肤。含有高度水合化角蛋白的角质细胞提供了亲水环境,便于亲水药物通过。小分子药物或离子型化合物可经跨细胞通路进入体内,但药物通过速率较慢,甚至易被细胞吸附而消除。
(2)细胞间通路(Intercellular route)
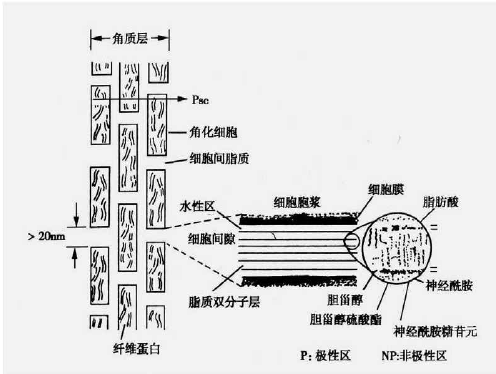
药物通过细胞间通路主要是通过细胞间脂质基质扩散。角质细胞与细胞间质紧密堆积形成的脂质双分子层,类似一种“砖墙”结构,严格限制外界物质侵入。又由于角质细胞的特殊形状,导致细胞间通路的蜿蜒曲折。细胞间结构域是一个交替的双层结构区域,药物必须依次不断地通过水性区和脂质域进行扩散。这条路径通常被认为是小分子的、不带电的药物透过皮肤的最常见路径。亲脂性的小分子药物(r<4,Ko/w>1)趋向于细胞间通路的自由体积扩散,亲脂性的大分子药物(r>4,Ko/w>1)趋向于细胞间通路的径向扩散。
图5 角质层“砖墙”结构示意图[24]
(3)皮肤附属器通路
皮脂腺口、汗腺导管等为药物提供了可快速直接通过角质层的通道。然而,由于皮肤表面的皮脂腺、汗腺仅占据很小的面积 (通常是皮肤表面积的0.1%),这限制了药物制剂可直接接触的面积。由于离子型药物及水溶性大分子(Ko/w<0.01)在角质层透过速率很慢,主要通过皮肤附属器吸收[16, 23]。
2.影响药物透皮吸收的因素
影响药物经皮吸收的因素主要分为生理因素、药物性质、给药系统三个方面。
(1)生理因素
较高的皮肤温度高会使皮下血管扩张,血流量增加,药物吸收也会增加;湿润的皮肤,可增强角质层的水合作用,使其疏松而增加药物的渗透;皮肤的清洁程度也影响药物的渗透,去除毛囊、皮脂腺及角质层的堵塞物有利于药物的渗透;角质层的厚度影响药物经皮吸收的效率,但角质层厚度与用药部位、年龄、性别等多种因素有关;皮肤的屏障作用在皮肤病变状况下会发生破坏,如角质层受损、皮肤发炎、患湿疹时,可使药物吸收的速度及程度大大增加,但可能引起疼痛、过敏及中毒等副作用。
(2)药物的性质
具有系统活性的药物要到达靶组织,必须具有一定的物理化学性质,以促进药物通过皮肤吸收并进入微循环。药物的性质决定其在皮肤内的转运速度。一般而言,低分子量、低熔点、药理作用强的小剂量药物易透过皮肤并产生药效作用。另外,由于角质层具有类脂膜的通透性,其下的活性表皮层是水性组织,因此油/水分配系数适中的药物具有较好的透皮渗透系数,穿透作用大。若药物在油、水中均难溶,则很难透皮吸收。非常亲油的药物可能聚积在角质层而不被吸收。对于水溶性药物而言,虽然透皮渗透系数小,但当溶解度大时可能有较高的皮肤渗透速率。
因此符合一定条件的药物才适合于经皮给药,但大多数药物不能满足此条件。因此,如何使药物突破角质层进行透皮吸收,是经皮给药系统研究的重点。
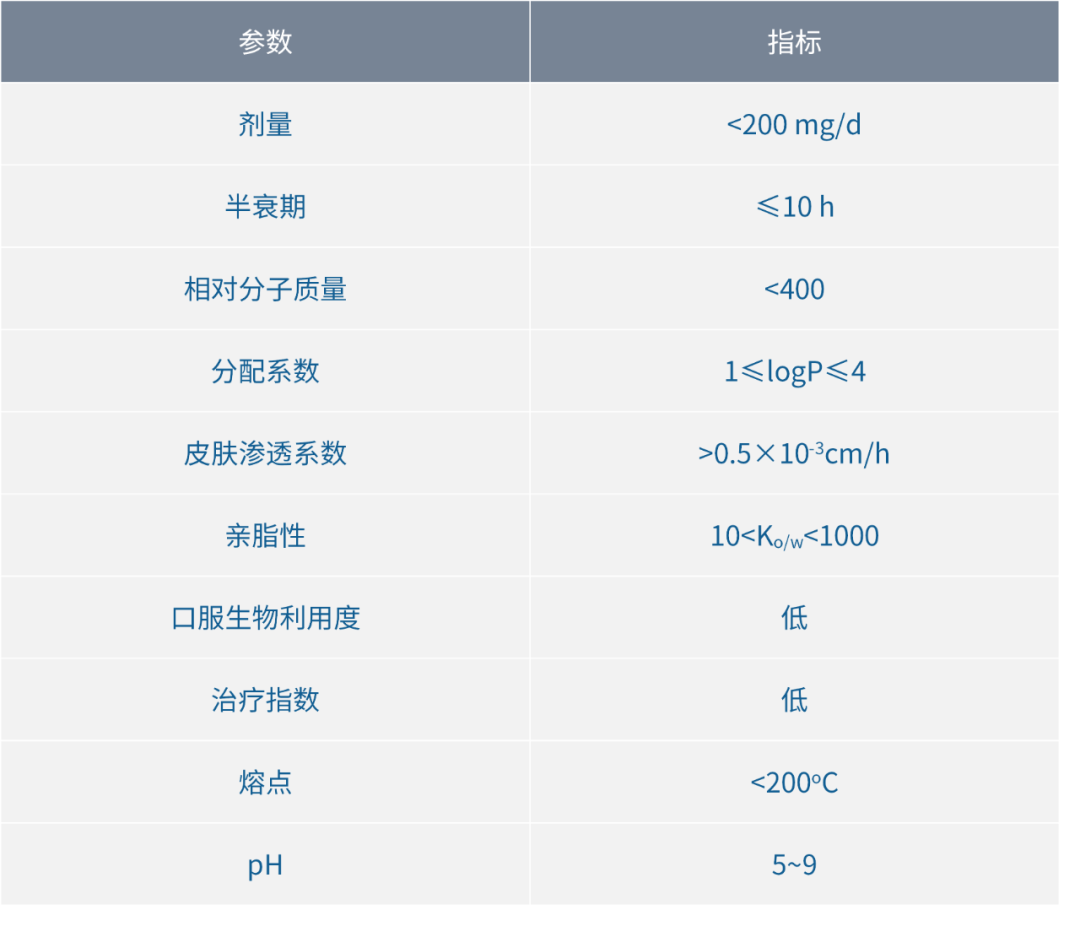
表1 适合经皮给药的药物性质[25]
(3)给药系统
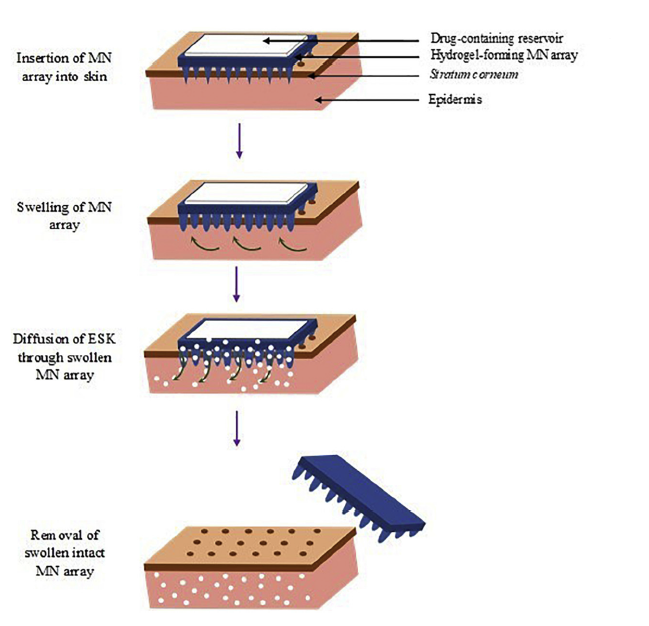
近年来,透皮给药技术已从单纯依靠被动扩散的简单方法发展到动态响应外界刺激的药物释放系统。目前经皮给药已经成为一种成熟的技术,通过控制并预设药物释放到病人体内的速度,可以很容易地在需要的时候使用或中断药物的作用。第一代经皮给药是小剂量、亲脂、低剂量的药物。第二代经皮给药采用超声、离子导入和化学增强剂给药。第三代经皮给药使用了微针、电穿孔、热消融、微晶磨皮等技术[26]。其中微针技术已经克服了皮肤中的物理障碍,可以透过角质层穿刺皮肤但不会触及神经,在皮肤上形成孔道,使药物释放[27],并最终实现了可穿戴生物传感器的控制传输。
图6 微针作用机制[28]
四、经皮吸收药物
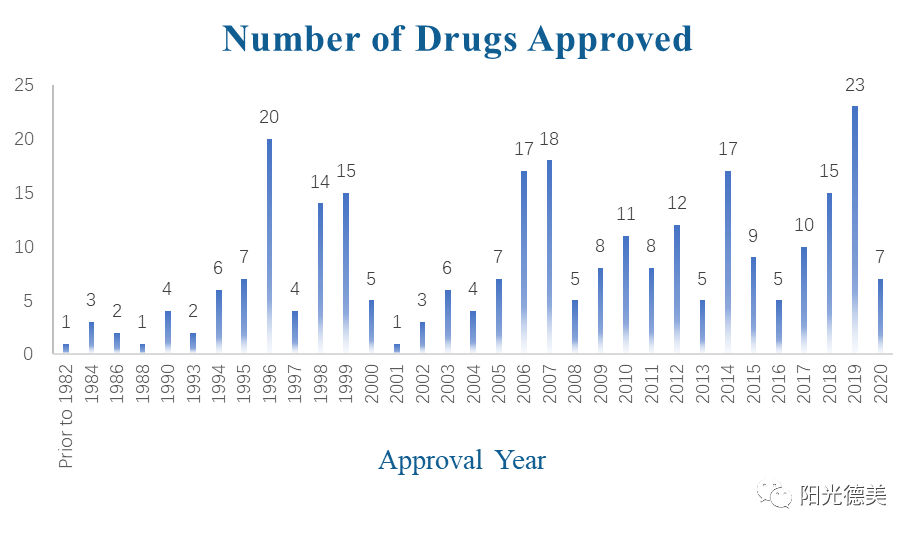
自1982年美国上市第一个经皮给药剂型产品——东莨菪碱贴片以来,经皮给药制剂引起了广泛关注并有了长足发展。近年来,人们对经皮给药作为一种有效的给药途径越来越感兴趣。下图为有史以来美国食品和药物管理局(FDA, USA)批准的透皮药物数量(FDA Orange Book, 2020.05)。
图6 每年FDA批准的经皮给药制剂数据(1982~2020.5)[29]
经皮给药制剂因其相对于其他剂型和给药途径的独特优势,成为最常见、最重要的一类药物。FDA已批准的经皮给药系统涉及高血压、心绞痛、晕吐、女性绝经期综合征、阿尔茨海默氏症、重度抑郁症、男性性腺功能减退症、重度疼痛、局部疼痛、尼古丁依赖、避孕和尿失禁等疾病。
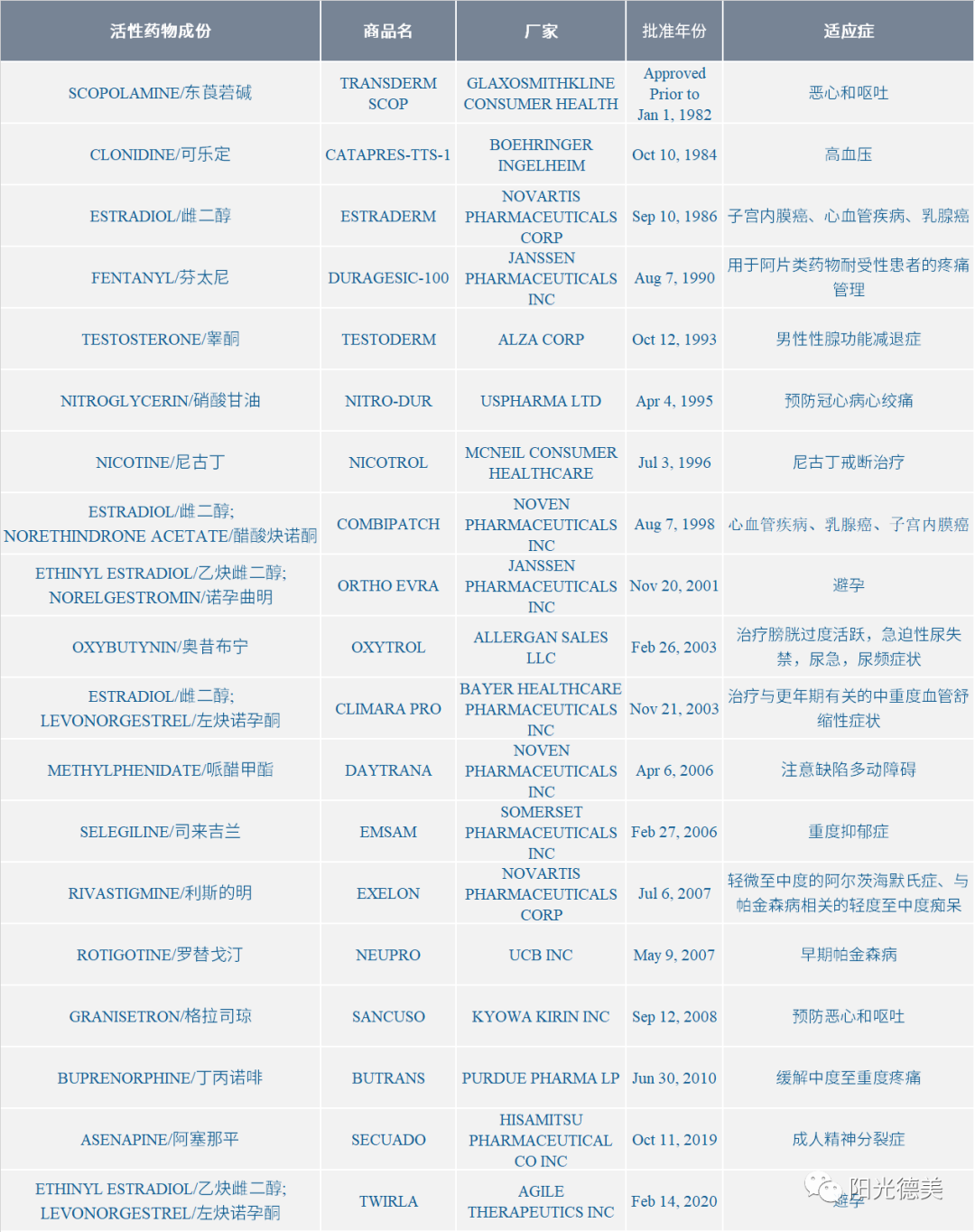
目前经皮给药制剂的活性成份不多,经FDA批准的经皮给药制剂见下表。
表2 经FDA批准的经皮给药制剂[29]
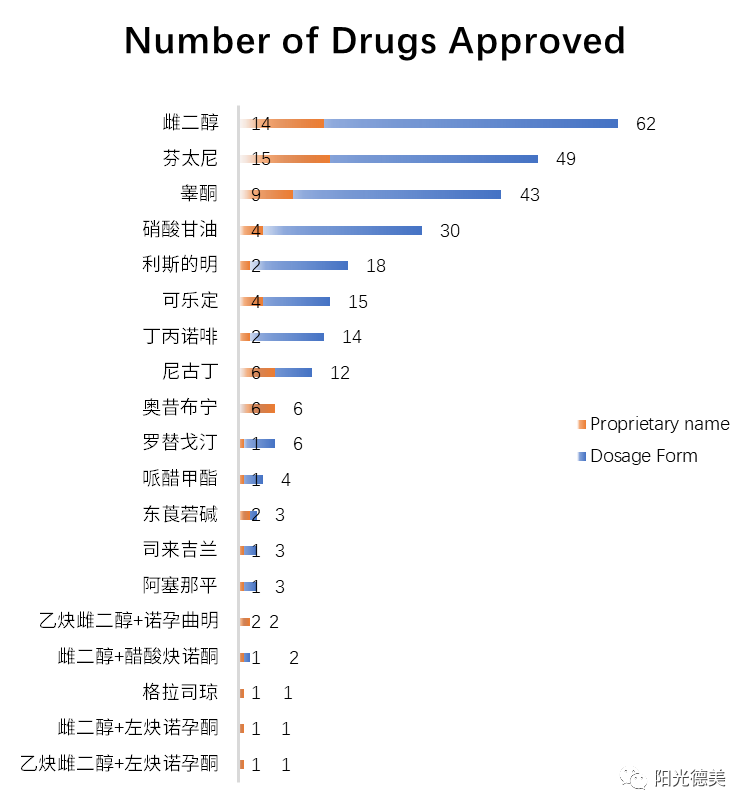
目前批准的经皮给药的活性成份较少,这也反映出这项技术的局限性。经皮给药并不适合所有药物。目前已批准药物中以雌二醇为活性成份的药物为14个商品(共62个剂型)。
图7 同一活性成份批准的药物数量[29](注:分别按商品名和剂型统计,数据截止至2020年5月)
五、经皮吸收药物的药代动力学模型
药代动力学模型通常用于研究药物进入和离开人体的命运,可预测或分析药物通过皮肤的吸收情况。房室模型是依据药物的浓度用数学方程预测药物在组织/体液中的处置过程。房室模型考虑的是平均浓度,不随房室内位置的改变而改变。许多简单的模型仅用一两个房室来表示皮肤。
1.一室模型
一室模型是最简单的模型,也是研究药物透皮扩散机制的主要模型,以角质层、活性表皮层、表皮层、或表皮层和真皮层表示单室。对于大多数化合物而言,以角质层为单室的模型已经代表了皮肤对化合物经皮吸收的屏障作用。
图8 一室模型[30]
一室模型可被分为三类。在第一类一室模型中,无论是角质层还是活性表皮层都代表着皮肤的屏障作用和贮存能力,并假设其他皮肤层对屏障作用和贮存能力无关紧要。第二类一室模型用复合皮肤层的特性描述皮肤的屏障功能和贮存能力,包括角质层和活性表皮层(如表皮层),可能包含全部或部分真皮层。描述这种类型模型的文献往往没有明确规定在使用这种模型时应该包括哪一层皮肤。第三类模型中描述了一个混合模型,其中渗透率是受限于角质层,但皮肤的贮存能力是由活性表皮层控制的。在这一类模型中忽略了活性表皮层对渗透的阻力。
2.二室模型
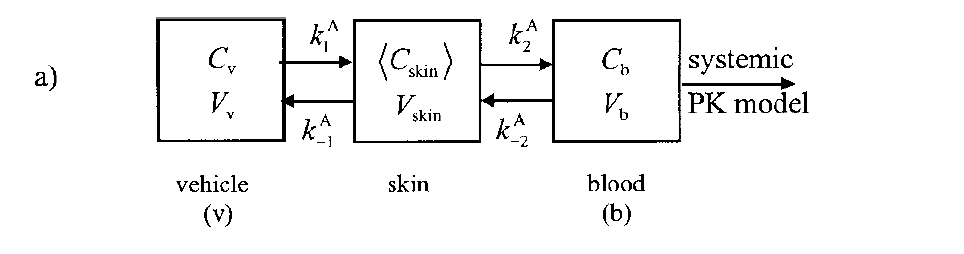
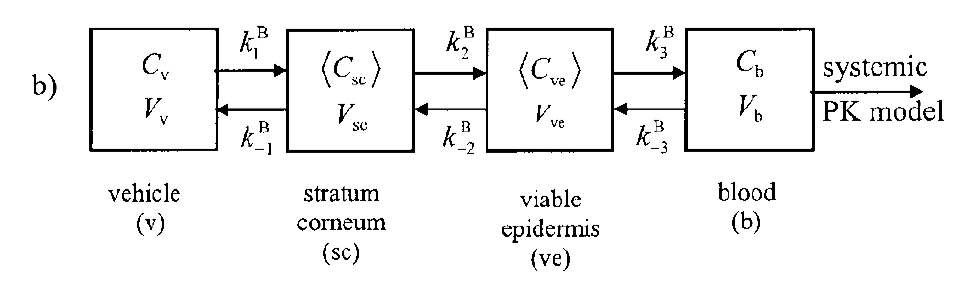
由于高脂溶性药物的经皮吸收不仅受到角质层的屏障作用,还受到活性表皮的阻碍影响。而且一室模型仅考虑了房室的平均血药浓度,忽略了房室模型速率常数相关的生理参数。Kelly等描述了一个符合房室模型的简单、系统的速率常数定义方法,在一定模型的基础上提出了二室生理相关药动学模型[31]。该模型综合考虑了角质层和活性表皮层的贮存能力和渗透系数。
在二室模型中,将皮肤分成两个房室,以角质层为一室,以活性表皮层、或活性表皮层和真皮层为二室。模型图中虽以活性表皮层表示二室,但实际上代表了存在于角质层和血液之间的所有亲水层,将角质层与血液分开。真皮层被完全血管化,药物迅速地从真皮层入血。除了以皮肤作为房室,还以载体和血液分别作为一个房室。二室模型更准确地反映了皮肤的生理特性,对高脂溶性化合物透皮吸收的描述较一室模型更合理[32]。
图9 二室模型[30](注:各房室i的平均浓度Ci分别为载体、表皮、角质层、活性表皮层和血液分别表示为v、epi、sc、ve或b)
还有一些房室模型中,血液被一个或多个房室所取代,这些房室代表了化学物质在体内或表皮层和真皮层下方的深层组织中的分布。
六、生物分析
由于药物的经皮吸收不同于其它的吸收过程,药物从皮肤渗透并进入到体循环要经过一系列的动态过程,因此它的吸收不属于一级动力学,不会出现明显的“峰谷”现象。药物经皮吸收后,在低血药浓度峰值之后,由于角质层有很大的贮库作用和较低的运输能力,常接着一个长时期的非常低的血药浓度扩散期,这一扩散期可持续数日之久。了解这一药代动力学特点有助于了解长期用药后的积累作用[31]。
由于经皮给药制剂一般剂量较小,且不能完全穿透具有多层生物膜结构的皮肤,经体内吸收的量少,同时存在众多的干扰杂质,难以分离纯化,因而对体内药物浓度的直接检测要求较高的灵敏度。
在采用体内药物浓度法研究药物在体内的动态变化规律时,通过采用的测定样本有血液、唾液、尿液以及其他体液,应用最多的是血液[31]。
经皮给药系统与口服给药相比,最主要的药代动力学特点就是避免了肝脏代谢的首过效应。再加上口服给药的低生物利用度,经皮给药使用更低的剂量便实现类似的血浆浓度。但由于缺乏肠道代谢和肝脏首过效应,药物中间代谢物的情况有所不同。
图10 健康绝经后妇女口服与经皮给予雌激素后血浆雌二醇和代谢物雌酮浓度的差异[33](A:多次口服雌二醇(1 mg/day)后血浆雌二醇和雌酮的平均浓度。B:多次使用雌二醇凝胶(0.75 mg/day)后血浆中雌二醇和雌酮的平均浓度)
不同的经皮给药系统也会影响血浆中药物浓度。
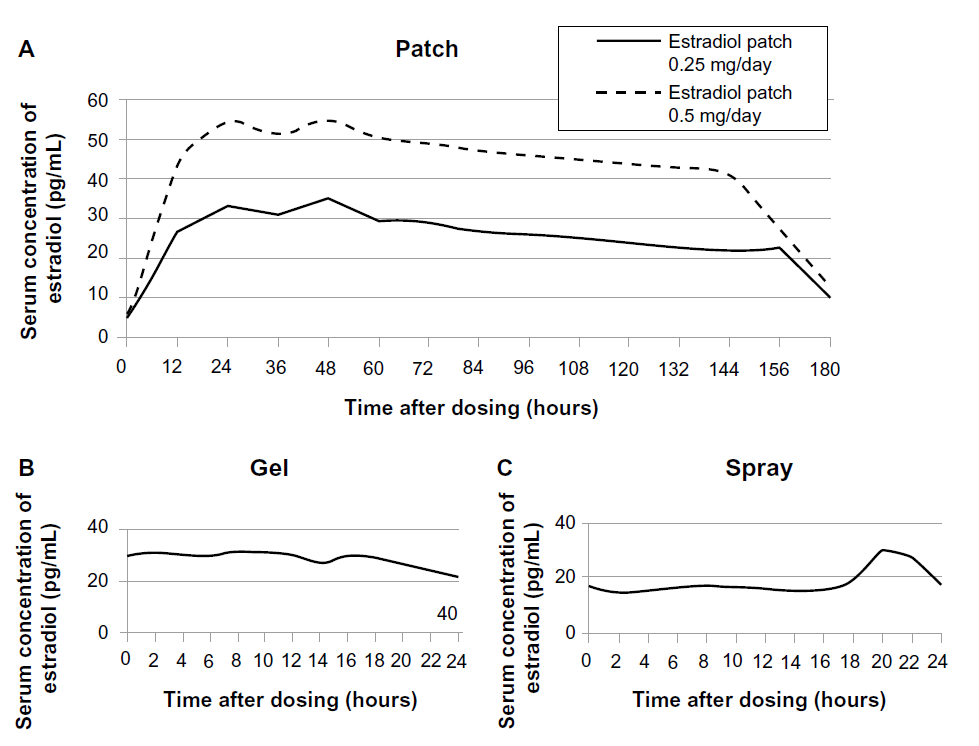
图11 健康绝经后妇女使用不同的雌激素经皮给药系统后血浆中雌二醇平均浓度[33](A:使用雌二醇贴剂7天(0.25 mg/day和0.5 mg/day)后血浆中雌二醇平均浓度。B:使用多剂量的雌二醇凝胶(0.75 mg/天)后血浆中雌二醇平均浓度。C:经皮给药(喷雾1.53mg/天)后血浆中雌二醇平均浓度)
我们采用HPLC-MS/MS法同时测定人血浆中奥昔布宁及其代谢产物去乙基奥昔布宁的血药浓度,具有选择性好、灵敏度高、操作简单等优点。奥昔布宁及其代谢产物去乙基奥昔布宁在人体血浆中浓度较低,本法采用固相萃取的处理方法处理血浆样品,定量下限为0.05 ng·mL-1,可以更准确的测定血浆中的药物浓度,SPE与传统的液液萃取法相比较可以提高分析物的回收率,更有效的将分析物与干扰组分分离,减少样品预处理过程,使操作简单、省时、省力。
图12 单次敷贴24 mg/36cm2奥昔布宁贴剂后平均血药浓度-时间曲线(n=12)[34]
七、结语
经皮给药制剂相比于其它给药途径,更具有药理学优势,大大提高了患者的可接受性和依从性。因此,在过去几十年里,它们一直是药物研究和研发的一个重要领域。但由于皮肤的结构及特性,也限制了经皮给药制剂的种类。随着给药系统的不断发展,经皮吸收制剂将会有更广泛的应用。因此,开展经皮给药制剂药代动力学研究和生物分析,对进一步了解药物在体内吸收、分布、代谢和排泄过程的特点,最大限度地发挥药效和降低毒副作用,指导临床合理用药,具有重要的理论和实践意义。