ADE是病毒借助非中和抗体介导的胞吞作用,进入没有病毒受体的机体细胞。怎么看都像病毒对人体防御系统的适应和反击?我们的策略呢?
--挑食喵的前言
抗体依赖的增强作用(Antibody- dependent enhancement,ADE) 是病毒感染后(疫苗接种类似),产生的抗体为非中和或弱中和作用,此类抗体促进病毒进入和感染宿主细胞,导致传染性和毒力增强。
1973年Halstead等科学家在登革热感染中描述了ADE,认为主要机理是结合病毒的抗体,其IgG Fc段和细胞表面FcγRs交联,形成多聚体,并通过胞吞内化,病毒借机进入细胞内,复制,增殖,产生感染。
FcγR及其功能
FcγR分类及免疫细胞表达

其中FcγRIIb、胞内段为ITIM(immunoreceptor tyrosine inhibitory motif,免疫受体酪氨酸抑制基序),FcγRIIIb不含胞内段。其余FcγR均为ITAM(immunoreceptor tyrosine activating motif,免疫受体酪氨酸激活基序)。
B细胞只表达FcγRIIb(参与生发中心高亲和力抗体产生),T细胞不表达 FcγR。
FcγR信号通路
①FcγR被IgG免疫复合物交联
②ITAM磷酸化,激酶SYKSRCPKC激活
③钙离子内流
④Actin重排,吞噬IgG免疫复合物
⑤转录激活
⑥细胞因子和趋化因子释放
功能
脱颗粒
颗粒细胞(中性粒,碱性粒细胞,酸性粒细胞)在活化后,产生活性氧(reactive oxygen species,ROS)活性氮(reactive nitrogen species,RNS),产生细胞毒性,抗微生物感染。另外,钙离子内流,也会出发脱颗粒( 丝氨酸蛋白酶,白三烯,抗菌活性蛋白质,如溶菌酶和乳铁蛋白,以及抗菌肽,如α防御素等)。
NK细胞也类似,激活后,释放穿孔素和颗粒酶等,产生抗病毒活性。
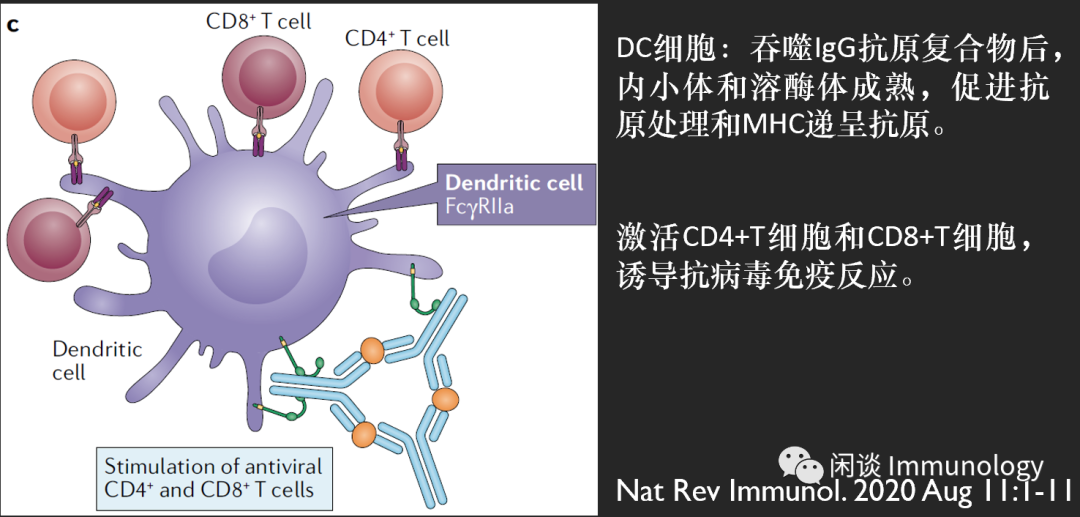
吞噬及抗原递呈
FcγR被交联激活后,DC细胞,单核细胞,巨噬细胞诱导IgG调理素作用,吞噬病毒和感染的细胞(病毒在其中复制),称之为抗体依赖的细胞胞吞作用(
antibody- dependent cellular phagocytosis. ADCP)。
ADE
一些研究显示:体内非中和抗体,可能会导致ADE。
登革热ADE
ADE最早的报道来自于登革热。在预先感染登革热后,产生的非中和抗体,在再次感染登革热时,不但不能起到保护作用,而且会引起ADE,促进病毒感染(文献4)。
ADE其实也是借助了抗体介导的胞吞作用(ADCP),其中FcγRIIa和FcγRIIIa其促进作用,FcγRIIb起抑制作用。
通过胞吞进入细胞的病毒,在吞噬体低pH环境下,包膜蛋白结构变化,促进病毒融合和感染。通过这种方式,病毒可以进入没有病毒受体的细胞,如髓系细胞,上皮,内皮细胞等。
ADE此后在HIV,埃博拉,流感等都有报道。
冠状病毒ADE
在SARS-CoV,MERS-CoV都有ADE的报道,主要通过FcγRIIb介导。抗Spike蛋白抗体,灭活疫苗,以及感染病人血清,在体外模型,及小鼠,非人灵长类动物都有ADE的报道,但是据此不能预测病人体内的情况。
SARS-CoV-2
在SARS-CoV-2(COVID-19致病病毒)灭活疫苗和中和抗体,临床前研究数据(来自于小鼠,大鼠,非人灵长类等),显示保护作用,没有发现ADE(文献12,13,14)。
但是人FcγR和模型动物还是有很大区别的,因而临床前数据不能完全预测人体情况。虽然人源化FcγR小鼠已经开始使用,但是其结果也不能完全模拟人体。
COVID-19病人血清治疗,临床研究未显示增进疾病,提示无ADE。这是SARS-CoV-2和SARS-CoV的区别(文献16)。
未来抗体及疫苗研发提示