IL-1家族
IL-1家族有抗炎和促炎细胞因子,根据共有受体或共受体结合分为三个亚家族:IL-1、IL-18和IL-36。
IL-1亚家族包含:IL-1α,IL-1β,IL-33,结合共受体IL-1R3
IL-18亚家族包含:IL-18,IL-37结合共受体IL-1R5(也称之为:IL-18Rα)
IL-36亚家族包含:IL-36α, IL-36β, IL-36γ,IL-36Ra 和 IL-38,结合受体IL-1R6
IL-1家族的每个成员都包含一个保守的三个氨基酸共有序列AXD,其中A是一个脂肪族氨基酸,X是任何一个氨基酸,D是天冬氨酸。
IL-1-IL-1R信号通路
IL-1β与IL-1R1(启动炎症信号)
IL-1受体1(IL-1R1)和辅助受体IL-1R3均以完整的膜蛋白形式存在。
IL-1β与IL-1R1结合后,受体发生构象变化,使IL-1β与受体的第三免疫球蛋白区结合。
IL-1R1的这种构象变化与IL-1R3结合,产生异源三聚体复合物。
IL-1R1和IL-1R3胞外结构域的接近,导致细胞内TIR结构域聚集,从而导致MYD88的合成和炎症信号通路的启动。

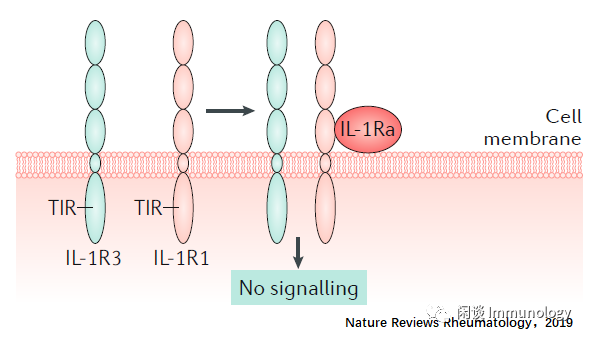
IL-1Rα与IL-1R1(无信号传递)
IL-1受体拮抗分子(IL-1Ra)与IL-1R1结合后,其构象发生了与IL-1β不同的变化。这种构象变化,不招募IL-1R3,也不会发生信号传递。
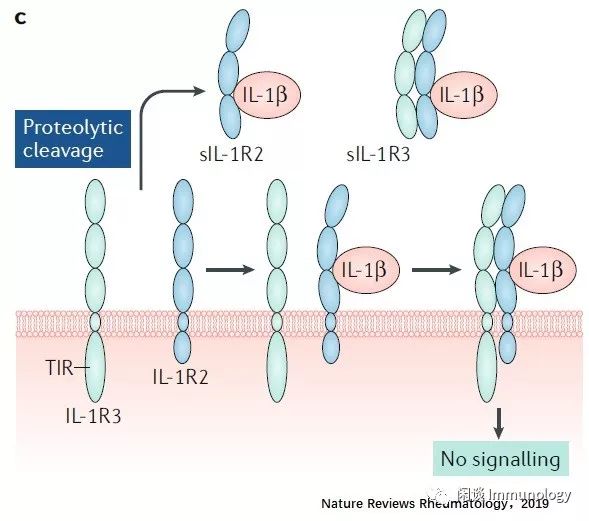
SIL-1R2/SIL-R3与IL-1R1结合(无信号传递)
IL-1R2缺乏TIR结构域,因此是诱饵受体。IL-1β以与IL-1R1类似的方式与IL-1R2结合,并与IL-1R3相结合,而MYD88不能与IL-1R2的胞内区结合,不能产生信号传递。
IL-1R2的可溶性形式(SIL-1R2)可由IL-1R2的蛋白水解形成,并能与IL-1β结合,中和该细胞因子,SIL-1R2也可以与SIL-1R3形成复合物,其增加了中和IL-1的能力。
IL-1家族与炎症性疾病
IL-1亚家族
IL-1α
在进化上,IL-1α是IL-1家族中最古老的成员,在细胞表面受体进化之前就被认为是早期生物体中的转录因子。IL-1α在结构上与成纤维细胞生长因子有关,并参与皮肤修复过程。
IL-1α与IL-1β五个区别:
Pro-IL-1α组成性存于健康人体间充质细胞中,pro-IL-1β仅存在于常住巨噬细胞中;
pro-IL-1α分子是活性的,而Pro-IL-1β需要通过caspase-1进行剪切,才激活;
IL-1α作为一种完整的膜蛋白发挥作用,而IL-1β不存在于细胞膜上;
IL-1α在核内是活跃的,而IL-1β在细胞核中不存在;
IL-1α在疾病状态的体液循环中很少报告,而IL-1β在健康和疾病的体液循环中都存在。
骨关节炎
在世界范围内,骨关节炎(OA)是关节疼痛的最常见的原因,尤其是在老龄化人口中。IL-1α,以及IL-1β和IL-1家族的其他成员,都存在于OA患者的滑膜液和滑膜中。但是至今无以IL-1α为靶点的人体研究。
川崎病
川崎病(Kawasaki Disease)是一种血管炎,其中IL-1α可能参与其中。任何内皮细胞应激,如系统性红斑狼疮(SLE)或川崎病,大释放含有活性IL-1的凋亡小体。
此外IL-1α在银屑病关节炎,风湿性关节炎等都有研究。
一种IL-1α单克隆抗体在开发,完成了结肠癌三期临床研究( NCT02138422,Xilonix,XBiotech, Inc. ),但尚无在自身免疫病的临床研究。
IL-1β
IL-1β是IL-1家族中研究最多的成员,与几种风湿病有关 。
IL-1β与风湿病的相关性可归因于髓系细胞在关节的病理浸润。2019年的一项临床研究中,以骨关节炎(OA)、白细胞丰富的风湿性关节炎(RA)或缺乏白细胞的RA为特征的关节炎患者,滑膜组织进行了单细胞RNA测序、流式细胞术检测成纤维细胞、T细胞、B细胞和单核细胞,结果发现,Z评分高的关节炎中,在单个核细胞,而不是T细胞,IL-1β占主导地位。
单核细胞富集TLR信号通路,髓系白细胞活化,通过MYD88依赖信号,产生细胞因子,炎症小体组装,IL-1β激活。
一项重要的临床研究
CANTOS ( Canakinumab Anti-inflammatory Thrombolysis Outcomes Study ),10,061人的全球随机安慰剂对照研究。Canakinumab( 诺华公司产品 )是一种针对IL-1β的中和人单克隆抗体,将减少第一次心脏病发作,或中风患者发生第二次心血管损伤。这项为期4年的研究达到了首要和次要终点。也证实了IL-1β在骨关节炎,二型糖尿病等中的作用。
痛风
痛风是一种独特的IL-1β介导的疾病.痛风的急性发作始于滑膜巨噬细胞吞没尿酸单钠晶体,产生IL-1β。脂肪酸通过TLR2信号表达IL-1β基因和pro-IL-1β合成,尿酸晶体被滑膜巨噬细胞吞噬,NLRP3被激活,caspase-1切割pro-IL-1β释放成熟的IL-1β到滑膜间隙;IL-1β介导的PGE 2通过增加环加氧酶2(Cox 2)的诱导引起疼痛。痛风对anakinra,rilonacept,和Canakinumab有反应。
幼年特发性关节炎(sJIA)和成人斯蒂尔病(AoSD)
IL-β中和抗体Canakinumab被FDA和欧盟批准用于sJIA和AoSD的治疗。
骨关节炎
IL1β与软骨流失和破坏性OA的发病机制有关,在疾病早期,髓系细胞浸润滑膜间隙,是IL-1β的来源。随着病情的发展,浸润性髓系细胞减少,滑膜衬里细胞成为IL-1β最有可能的来源。
相关药物临床研究
Lutikizumab (ABT-981,AbbVie),一种新型抗体,具有中和IL-1α和IL-1β的双重功能。NCT02384538,一项多中心,随机,双盲,安慰剂对照研究,比较ABT-981与安慰剂在糜烂性手骨关节炎患者中的安全性和有效性。尽管能够充分阻断IL-1,但与安慰剂相比,lutikizumab并未改善糜烂性HOA的疼痛或影像学结局。
AMG108 ,Amgen,IL-1R1抗体,NCT00369473(Long-Term Assessment of Safety and Physical Function With AMG 108 in RA)每4周注射一次抗体,12周后用WOMAC疼痛评分评估关节疼痛。使用AMG 108治疗膝关节疼痛程度最高的患者,其WOMAC疼痛评分中位数为-63,而安慰剂治疗的患者为-37
小分子NLRP3口服治疗炎症抑制剂,未来可能也是一个方向。
IL-33
L-33是IL-1亚家族的第三个成员,最初被鉴定为当时孤儿受体IL-1R4的配体。IL-33先与IL-1R4形成异二聚体,然后与IL-1R3形成异三聚体复合物。IL-1R4信号转导促进TH2细胞应答,是IL-33与变态反应相关的基础,而IL-33也与TH1细胞反应有关。中性粒细胞弹性蛋白酶和组织蛋白酶,切割Pro-IL-33,使其变成成熟形式,发挥促炎作用。pro-IL-33在转入核内,作用未知。
IL-33-IL-1R4相互作用触发Th2细胞反应,减少干扰素γ的产生,增加嗜酸性粒细胞和2型先天淋巴样细胞的数量。IL-33的治疗也改善了CIA(collagen- induced arthritis)。
IL-33参与RA,这一证据主要来自于RA从疾病严重程度和存在之间的相关性滑膜、滑液或循环中的IL-33,IL-33诱导激活肥大细胞也与RA生物学有关。IL-33刺激组胺、趋化因子和滑膜肥大细胞的抗炎细胞因子,其能够抑制单核细胞活化。虽然抗IL-33和IL-1R4的抗体在哮喘和接触性皮炎等过敏性疾病的临床试验中( ANB020,AnaptysBio, Inc. ,Proof of Concept Study to Investigate ANB020 Activity in Adult Patients With Severe Eosinophilic Asthma Phase2,NCT03469934 ),但RA患者尚未接受IL-33阻断治疗。
总体而言,IL-33可能在风湿病中具有促炎作用,但也可诱导免疫反应为TH2细胞介导的反应,从而参与抗炎机制。
IL-18亚家族
IL-18
类似于IL-1R,IL-18首先被合成为非活性的,没有信号肽的前体,并且仍然是细胞内细胞因子,直至其通过caspase-1剪切和释放。然而,与IL-1α类似,pro-IL-18在间充质细胞(如内皮细胞)、整个胃肠道上皮细胞、角质形成细胞和大脑中均有表达。
许多研究已经研究了IL-18基因多态性与RA风险之间的关系,但是一项Meta分析显示没有一致的关联。一项IL-18BP治疗RA的临床试验,后来被生产厂家终结了。所以IL-18与RA的发病相关性并不确认。一些临床研究,显示IL-18升高和SLE是相关的。但是还没有IL-18相关药物治疗SLE。
IL-37
IL-37在IL-1家族中具有独特的作用,因为这种细胞因子广泛地抑制了先天炎症以及后天免疫反应。
几项研究显示RA、sJIA或AOSD与患者循环IL-37浓度升高相关,在RA患者IL-37升高与T细胞活化相关。
IL-37在风湿病(如sJIA、AOSD和RA)中有明显的作用,其多态性与疾病的严重程度有关。重组人IL-37对小鼠多种疾病模型炎症的抑制作用表明,IL-37可作为治疗风湿性和非风湿性疾病的潜在药物。
药物临床研究:
NCT03835624,Interleukin 33 in Juvenile Idiopathic Arthritis Patients,Benha University,正在招募病人。
IL-36亚家族
IL-36
一般而言,IL-36细胞因子功能主要在皮肤病,目前尚无数据支持在全身疾病中的作用。
IL-36细胞因子在银屑病中有激动作用,IL-36在人的RA中没有明显作用。然而,IL-36Ra可能在风湿性疾病,特别是PSA有一定作用。
IL-38
IL-36细胞因子与IL-1R6的结合传递一种促炎信号,IL-38与IL-1R6的结合导致炎症的抑制
IL-38似乎是B细胞的产物,因为这种细胞因子存在于扁桃体和增殖的B细胞中。
循环IL-38在RA和SLE中增加。
IL-38是一种抗炎细胞因子,其性质与IL-37相似.IL-38抑制T细胞活化,因此不仅在RA中起作用,而且在斑块性银屑病中也可能起作用。
参考文献
Charles Anthony Dinarello,The IL-1 family of cytokines and receptors in rheumatic diseases,Nature Reviews Rheumatology,2019
Diana Boraschi,et al,The family of the interleukin-1 receptors,Immunol Rev . 2018 Jan;281(1):197-232
Alberto Mantovani,et al,Interleukin-1 and Related Cytokines in the Regulation of Inflammation and Immunity,Immunity. 2019 Apr 16;50(4):778-795.