来源
中国医药工业杂志 2019, 50(10)
作者
张伊洁,郭宁子,刘万卉,杨化新
中国食品药品检定研究院
烟台大学药学院
摘要
作为缓控释注射剂的关键组成部分,丙交酯乙交酯共聚物(PLGA) 通过影响药物递送系统的降解和药物释放行为来达到以可控的方式提供持续释放药物的目的。
PLGA 关键质量属性的表征对于确保可控型缓释药物的体内外性能的再现性至关重要。
本文概述了缓控释注射剂的主要类型、PLGA 的相关特性、以PLGA 为基础的缓控释注射剂的研究进展,并重点介绍了PLGA 关键质量属性的表征和分析方法,为PLGA 缓控释注射剂的质量控制和评价研究提供参考。
关键词
缓控释注射剂;丙交酯乙交酯共聚物(PLGA);质量控制;关键质量属性;表征;分析方法
正文 |
缓控释注射剂主要指具有缓控释作用的经局部、皮下或肌内注射给药的注射剂,不仅可通过减少给药次数来改善患者的顺应性,还可以调控药物在靶向病灶的释放,增强药物的安全性和有效性,已被广泛用于组织修复、免疫治疗和抗肿瘤治疗等[1—3]。
近年来,可注射型缓控释制剂在多肽类及半衰期短的蛋白类药物长效给药中的应用愈发引人注目,以生物可降解的高分子聚合物材料作为载体的给药系统更是目前研究的热点,常用的高分子材料包括合成的聚酯[4]、聚酸酐[5]、聚酰胺[6]、聚磷腈[7]、聚磷酸酯[8]、聚氨基酸[9],其中研究最多、应用最成熟的是聚乳酸(PLA) 和丙交酯乙交酯共聚物(PLGA)[10]。
PLGA 是由不同比例的丙交酯(LA,或称L) 和乙交酯(GA,或称G) 组成的共聚物,在人体内能够降解成LA 和GA 分子,而LA 和GA 是体内各种代谢的产物,所以PLGA 属于高度生物可降解和生物相容的聚合物。
自20 世纪60 年代引入PLGA 作为生物可吸收高分子材料以来,PLGA已经成为药物递送和生物医学系统发展中最常用的聚酯之一[11—13]。
关于PLGA 聚合物和PLGA 缓控释注射剂的分析方法,《中华人民共和国药典》2015 年版四部《供注射用乙交酯丙交酯》收载的质量标准仅限于分子量分布和丙交酯乙交酯的摩尔比(L:G),但影响缓控释注射剂药物释放机制的PLGA 关键质量属性却远不止上述2 项指标。
目前,专门针对PLGA 质量控制与评价方法的报道也比较少,本文结合美国FDA 批准上市的PLGA 缓控释注射剂的相关标准和文献,对微球制剂产品中PLGA 的关键质量属性表征和质控方法进行综述,期望有助于了解复杂缓控释注射剂产品的配方组成以及缓控释注射剂工艺的变化,为评价进口与国产缓控释注射剂产品之间的质量差异提供参考,为该类注射剂仿制药的一致性评价提供技术指导。
1
缓控释注射剂概述
从1989 年首个被FDA 批准的以PLGA 为载体的亮丙瑞林长效制剂上市到2019 年的30 年间,国内外被FDA 批准上市的PLGA 缓控释注射剂只有19 个[14] ( 见表1~3),这表明在开发临床用可注射缓控释药物递送系统方面的进展十分缓慢。
此外,这19 个PLGA 缓控释制剂主要分为3 种类型,即微球制剂、植入剂和原位凝胶制剂,同一剂型的不同药物释放周期从1 周到6 个月不等,不同释放周期反映了不同剂型的药物释放动力学的差异,这种差异是由PLGA 的相关属性及其载药量控制的。
1.1 微球制剂
微球制剂是指将药物溶解或分散到高分子材料载体中形成的粒径1~250 μm 的微小球状实体。微球常用的载体材料包括以明胶、淀粉、白蛋白等为代表的天然高分子材料和以PLA、聚乙醇酸(PGA) 及两者的共聚物PLGA 为代表的合成高分子材料,FDA 批准上市的PLGA 微球制剂共有12种(见表1)。

1.2 植入剂
植入剂是指药物和辅料通过熔融、吸热和辐射等方式制得的供植入人体的无菌固体制剂。
植入剂所用的载体必须是生物相容的,如常用的聚酯类PLGA 等生物降解材料,也可用硅橡胶一类的需按时从体内取出的生物不降解材料[15],FDA 批准上市的PLGA 固体植入剂共有3 种(见表2)。
1.3 原位凝胶控释剂
原位凝胶控释剂是指包含药物和适宜聚合物载体的溶液,经局部注射给药后在体温条件下能凝固成非化学交联的半固体或固体的凝胶型药物储库。
胶原蛋白[16]、壳聚糖[17]、明胶[18]、PLA、PLGA[19],这些可原位凝胶化的材料都可用来制备原位凝胶控释剂,FDA 批准上市的PLGA 原位凝胶制剂共有4 种(见表3)。
2
PLGA 简介
作为当前热推的生物可降解材料,PLGA 已被FDA 和欧洲药品管理局批准用作手术缝合线、组织工程以及注射用微球、埋植剂、凝胶等制剂的药用辅料;PLGA 作为应用度较高的生物可降解材料,是目前临床上可注射缓控释注射剂中应用最广泛的辅料之一。
通过调节PLGA 自身2 种单体的比例、相对分子质量和黏度等物理化学性质,可影响PLGA 在体内的降解速率,进而影响缓控释注射剂的包封率、载药量和释药周期等重要质量参数,最终实现以可控的方式使所载药物达到持续长效释放的目的。
传统的PLGA 制备方法包括开环聚合法[20—21]、直接聚合法[22]。
开环聚合法是目前较为常用、应用也较成熟的PLGA 合成法,分为开环无规共聚和开环均聚,前者合成无规共聚物,虽可通过控制不同的投料比例来合成不同组成的PLGA,但所得产物的无规程度和组成重现性难以控制;
后者合成交替共聚物,这种PLGA 具有结构规整和降解性能稳定的优点,但这种方法由于制备工艺复杂而不适合进行工业化生产。
与开环聚合法不同,直接聚合法是通过溶液缩聚或熔融缩聚来制备PLGA 共聚物的,溶液缩聚由于使用了大量有机溶剂而具有高污染和提纯困难的缺陷,熔融缩聚则凭借简单经济的工艺路线成为相关研究的主流,目前熔融缩聚的研究热点方向是制备相对分子质量较高和结构可控的PLGA[23]。
3
缓控释注射剂中PLGA 关键质量属性的分析方法
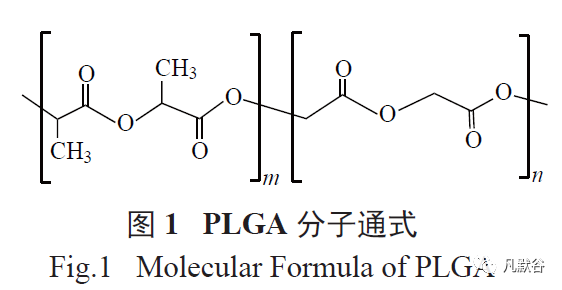
PLGA 一般为线形共聚物( 结构通式如图1 所示),玻璃化转变温度(Tg) 为40~60 ℃,易溶于二氯甲烷和三氯甲烷;GA 摩尔量低的PLGA,还可以溶于丙酮和四氢呋喃等溶剂;GA 摩尔量高的PLGA,在二氯甲烷、三氯甲烷中溶解度较高,而在丙酮和四氢呋喃等大多数溶剂中溶解度较差,当GA 摩尔量超过50%,只有在六氟异丙醇(HFIP)中可以溶解。
由于PLGA 的理化性质是由PLGA 关键质量属性所决定的,所以在某种程度上,缓控释注射剂发展的难点大部分是源自缺乏对PLGA 明确的分子水平上的全面理解。
因此,分析鉴别PLGA的关键质量属性对确保产品性能的可比性是至关重要的。
3.1 相对分子质量及其分布
用来表征PLGA 相对分子质量的参数有4 个,即重均分子量(Mw)、数均分子量(Mn)、多分散系数(Mw/Mn) 以及分子量分布曲线。
相对分子质量不仅能影响自身降解速率,更能影响缓控释注射剂所载药物的释放行为,因此获取准确的PLGA 相对分子质量信息对于比较不同生产商的不同产品或同一生产商的不同批次产品是不可或缺的。
其测定方法包括凝胶渗透色谱(GPC) 法、多角度光散射(MALS) 法、特性黏度(IV) 法、渗透压测定法等,其中只有GPC 法可以直接显示PLGA 的多分散系数,因而更为常用[24]。
GPC 法一般是通过聚苯乙烯外标(polystyreneexternal standard,PES) 来测定的。
以二氯甲烷为流动相,以1 ml/min 的流速接连通过3 根色谱柱,常用的色谱柱是孔径5 nm 的凝胶色谱柱(7.8 mm×300 mm,5 μm),但该法测得的结果易受PLGA 和PES 与溶剂之间相互作用的差异性的影响。
MALS法通过与GPC 法联用对分子从多个角度进行光强度测量,推断出0 ° 入射光时的散射光强度,从而通过简化的瑞利方程计算得到相对分子质量,此法不依赖于外标化合物,所得结果相对来说更准确。
IV 法操作简便、成本低,且试验精密度较高,但是样品用量大。
IV 法测定高分子聚合物相对分子质量的原理是基于Market-Houwink 方程,即[ η]=KMa,其中[η] 和M 分别是特性黏度和相对分子质量,K和a 是与温度、溶剂及高聚物本性有关的常数。
图2 为Durect 公司提供的关于特性黏度和相对分子质量之间的关系图(数据来源:https://www.absorbables.com),图2A~2D 分别是PLGA 中L:G=50:50、65:35、75:25、85:15 时的IV 和Mw 关系图。
从图2 可见,在一定的试验条件下,PLGA 的IV 与Mw 之间存在一一对应的关系,且随着Mw 的增加而增加。
由于高分子聚合物的Mw 一般在103~107,表达不如特性黏度简便,市售的PLGA 大多采用特性黏度来命名,如PLGA5A 中的“5”代表特性黏度范围为45~55 ml/g,“A”代表末端集团为羧基。
3.2 丙交酯乙交酯的摩尔比(L:G)
聚合物的组成对其降解动力学和溶解性能起着非常重要的作用。研究表明,当增加PLGA 中GA 的浓度时,PLGA 的降解速率会明显加快。
Skidmore 等采用一系列不同性质的溶剂分析证明了PLGA 的溶解度是随着L:G 中LA 比例的增加而增加的,并根据L:G 成功分离了相对分子质量相似但类型不同的混合PLGA[25]。
此外,如表4 所示,L:G 还会影响PLGA 的密度、Tg 和体内吸收周期等理化性质。
因此,L:G 是1 个调节药物递送系统中药物释放速度和聚合物降解速度的关键参数。
PLGA 的L:G 通常使用1H 核磁共振( 1H NMR)法测定,δ 5.2 和4.8 处的积分分别对应LA 的3 ° H和GA 的2 ° H,通过下面的公式计算L:G。
其中,PL 和PG 分别是LA 在δ 5.2 和GA 在δ 4.8的峰积分,ML 和MG 分别是LA 和GA 的摩尔分数,ML:MG 即为L:G 的摩尔比。
Pourasghar 等通过RP-HPLC 建立了一种可同时测定LA 和GA 单体含量的新方法[26],即先在优化后的碱条件下将PLGA 水解成单体,再用2,4'-二溴乙酰苯酮通过酯化反应将二者衍生化,增强其紫外吸收,并使之发生红移而不被所用溶剂和流动相的吸收峰所掩盖。
该定量方法具有快速、低检测限(0.1 μg/ml)、高精确度和高选择性的显著优点,非常适用于以PLGA 为载体的缓控释注射剂质量控制的常规检查。
3.3 PLGA 含量
PLGA 制备工艺复杂,最终产品中的PLGA 含量可能与预期含量不符,而这种差别可能影响药物递送系统的包封率和载药量,故制剂中PLGA 含量的测定是估算生产工艺的产量、调整用于含量测定的浓度、终产品快速质量控制等的基础[26—27]。
PLGA 的含量可以通过GPC、HPLC 和1H NMR 法测定,GPC 法需要使用PLGA 标准品,这会造成不同生产商之间具有不同的质量控制标准,不适合用于市场监管;
HPLC 法需要用碱水解,其中碱水解的程度、羟基酸的校正、聚酯的组成和校正以及标准品的纯度等都难以控制,这将导致所测结果的精确度偏低,可信性较差;
1 H NMR 法以苯甲酸(BA)作为内标化合物,测定结果具有良好的线性、准确度、稳定性、重现性和回收率,是当前PLGA 含量测定中应用比较成熟的方法,其计算公式如下。
其中,PBA 是BA 的纯度,IBA、ILA、IGA 分别是BA、脱水LA、脱水GA 的积分数,HBA、HLA、HGA 分别是BA、脱水LA、脱水GA 峰信号的质子数,MBA、MLA、MGA 分别是BA、脱水LA、脱水GA 的相对分子质量,WBA、WLA、WGA、WPLGA 分别是BA、脱水LA、脱水GA、PLGA 的质量,Wsample指的是样品称样量。
Zhang 等分别利用GPC、HPLC 和1H NMR 法对不同生产商的醋酸亮丙瑞林微球进行了相关研究[27],与供应商提供的PLGA 含量为75%的数据相比,GPC、HPLC 和1H NMR 法测得的结果分别为67.38%、71.35%和75.15%,由此可见1H NMR法在PLGA 含量测定中是准确度最高的方法,该法还能通过同时获得的LA 与GA 的含量计算得到L:G,是用于PLGA 缓控释注射剂质量控制的可靠且一法多用的检验工具。
3.4 分子结构与构型
由相关上市药物说明书与文献报道可知,临床上使用的可注射缓控释制剂中几乎全部使用线形PLGA 作为载体辅料,只有Sandostatin( 注射用醋酸奥曲肽) 用的是星形的、由葡萄糖引发合成的PLGA(Glu-PLGA)。
事实上,支链化PLGA 的形状不仅包括星形,还有环形、树形、梳形、多臂形等,相对分子质量相同但结构不同的PLGA 在化学、机械、扩散等性质上有较大的差异,最终可能影响所制缓控释注射剂在亲水性、降解速度、药物释放速率等方面的性能[28]。
PLGA 结构鉴别的目的不仅是要证明是否在线形分子中存在支化结构,更重要的是对支化分子的相关参数进行测定和表征。
分支比率(gM) 和每分子分支数(B) 是支化分子的特征参数,可以通过旋转半径(Rg) 或黏度分支指数(g'M)来计算,它们之间的关系式如下。
其中,K 为常数;α 用来衡量聚合物支化程度,介于0.33~1.0,α 值越小支化程度越高;Rg 与相对分子质量M 的关系图是一条直线的为线形聚合物,发生偏离的则是支化聚合物;
和
分别是M 相同的支化和线形分子的均方旋转半径;
[η]B 和[η]L分别是M 相同的支化和线形分子的特性黏度;e 是每种PLGA 特有的排水因子,范围为0.5~1.5,对星形或无规支化的聚合物,e 取0.75。
当确定了支化模型后,便可通过特定的算式来计算B 值,以星形模型为例,
Hadar 等将GPC 与黏度计、多角度激光散射仪、动态光散射仪、示差折光检测器连接起来组成GPC-4D 检测系统[29],通过对Glu-PLGA 的浓度、相对分子质量、旋转半径和特性黏度进行分析,成功表征了不同结构的PLGA。
结果显示,星形Glu-PLGA 的每分子分支单位数大约为3.2,线性PLGA的每分子分支单位数则为2,且线性PLGA 每分子分支单位数与其摩尔质量之间的关系图是一条近似水平的直线。
3.5 玻璃化转变温度(Tg)
Tg 发生在一个相当明确的温度下,无定形聚合物由玻璃态转变为高弹态,而不再具有易碎和玻璃状的特性。
PLGA 在室温条件下处于无定形状态,发生玻璃化转变时,其热膨胀系数、热容量、折射率等也会随之改变,从而间接影响降解速率。
传统测定Tg 的方法包括热机械法、差示热分析法(DTA)、差示扫描量热法(DSC) 等,热机械法测量结果易受样品尺寸和表面硬度的影响;DTA 和DSC 作为主流的Tg 测定法,测定结果与样品质量和加热速度有很大的关系。
He 等利用发光二极管(LED) 平行光源、温度控制器和电荷耦合器件(CCD) 数码相机等组成了微球成像系统[30],通过同时监测几种聚合物微球的折射率随温度变化的情况,实现了对不同聚合物Tg 的同时测量,与传统方法相比,该法具有更好的灵敏度和准确度,而且简单易行,同时能节约时间与能源。
3.6 末端官能团
末端官能团的性质对聚合物的降解和药物释放行为有一定的影响,一般来说,PLGA 的末端官能团有2 种,即酸封尾或酯封尾(如图3 所示),酸封尾的PLGA 因能催化酯键的水解而具有比酯封尾的PLGA 快得多的降解速度[31]。
最常用的开环聚合法合成PLGA 的过程中,若使用水来引发聚合反应,会生成酸封尾的PLGA,使用烷基醇则生成酯封尾的PLGA。
鉴别PLGA 封尾官能团最常使用的方法是13C NMR,若在δ 14 处存在甲基峰,则证明是酯封尾的PLGA[24]。
4
缓控释注射剂中PLGA 分析方法的研究展望
为了实现PLGA 在缓控释注射剂中的理想应用,必须将所有可能对药物递送系统的降解速度和药物释放机制产生影响的相关因素考虑在内,然而,在可注射缓控释制剂的发展中,PLGA 的表征往往仅限于特性黏度、相对分子质量和L:G,这些信息不足以解释不同批次和生产商产品之间存在明显差异的原因。
随着缓控释注射剂的应用越来越广泛,PLGA 的种类也会随着不同的控释要求而变得越来越丰富,不同相对分子质量、不同L:G 甚至不同分子结构的PLGA 混合物都有可能出现在未来的新型可注射缓控释制剂中,这将对建立分离和表征不同类型PLGA 的方法提出更高的要求,而这反过来也会增强人们对PLGA 缓控释注射剂的理解,使得制备性能相近或相同的缓控释注射剂成为可能,从而有利于开发相同辅料( 定性/ 定量一致性) 的仿制药。
参考文献
详见 中国医药工业杂志 2019, 50(10)