全球气候变暖和气候的不稳定,激发了人们对使用可再生碳资源及可持续生产化学品的需求。
蓝细菌是一种“负碳”生产化学品的理想细胞工厂,科学家可对蓝细菌细胞进行重新设计和改造,从而直接利用二氧化碳合成塑料、燃料、药物等。
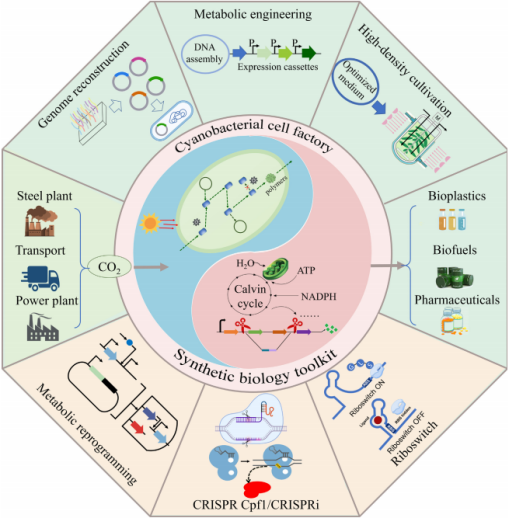
然而,将蓝细菌技术应用于工业化生产,目前仍存在一些挑战,例如生产率低、耐受性差和产品回收困难等。而解决这些难题的终极方案,很可能要通过合成生物学技术的进步来解决。
近日,上海交通大学生命科学技术学院食品与环境生物技术团队针对负碳合成生物学面临的挑战和解决办法进行梳理,并总结了合成生物学工具及其在蓝细菌中的最新应用,包括蓝细菌在生物医药、发电、未来星际探索方面的应用潜力等。
此外,他们还对未来蓝细菌投入工业化的生产应用提供了新视角,有助于研究者开拓新的方向,进而加速负碳合成生物的发展。
上海交通大学生命科学技术学院研究员陶飞表示,“这些方面有助于从事合成生物学工具开发的科学家了解现状,使他们快速地跟进蓝细菌的最新研究进展,并促进多领域的研究者共同开发跨学科的应用技术,将蓝细菌的应用价值进一步扩大化。”

图丨上海交大陶飞研究员为该论文通讯作者(左),上海交大博士生谭春林为该论文第一作者谭春林
如何来理解“负碳合成生物学”呢?我们知道,合成生物学是“合成生命”为特征的新兴学科,旨在改造、重建、创造新的生命分子和生命系统。它是多学科汇聚交叉形成的革命性底层技术,其应用领域广泛,包括能源、材料、医疗、农业、环境等。
而负碳合成生物学指的是,合成生物学的底层技术在固碳和减碳方面的应用。具体来说,是通过改造和创建微生物细胞,来实现二氧化碳的捕集、利用和转化。
陶飞认为,负碳合成生物学是一个没有“天花板”、前景广阔的领域。其原因在于,负碳合成生物技术可将固定二氧化碳和生产有用化学品有机结合,在实现减碳的同时,还能生产有价值的产品。
这会极大地改善全球共同的面临的环境问题,即温室气体过度排放给人类和地球造成的窘境,同时还能解除合成生物技术规模化生产对粮食资源的依赖。此外,从工业化的角度看,负碳合成生物技术使用二氧化碳作为原料,在降低工业品的生产成本方面的潜力十分值得期待。
图丨相关论文
10 月 14 日,相关论文以《负碳合成生物学:蓝细菌技术的挑战和新趋势》(Carbon-negative synthetic biology: challenges and emerging trends of cyanobacterial technology)为题发表在 Trends in Biotechnology 上[1]。
蓝细菌的“独门秘籍”:将二氧化碳转化为生物燃料和高价值化合物
实际上,多种底盘微生物都可用于负碳合成生物学,例如蓝细菌、真核藻类甚至于一些非光合细菌。而该团队为何唯独选择蓝细菌作为底盘进行重点研究呢?
陶飞指出:“我们看好蓝细菌的高效率和易于工程化的优势。它作为原核生物,天然具有较快的生长和代谢速率。现在发现生长最快的蓝细菌倍增时间与酵母菌类似, 可达 90 分钟。”
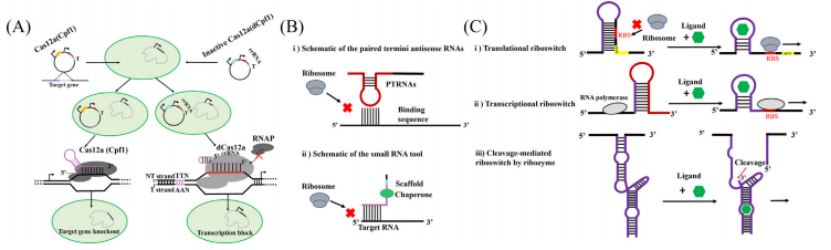
图丨蓝细菌合成生物学工具包方案
从有机物合成能力角度,蓝细菌与绿色植物相比,其单位面积的产出效率高得多,据测算有几十倍的差别。在工程化方面,蓝细菌遗传背景和基因操作工具相对成熟易于进行基因工程操作。
从蓝细菌合成产品来看,也具备独特的优势。陶飞举例说道:“它体内有较高的还原力和能荷水平,有利于推动合成反应的发生;它和植物具有亲缘关系、内膜系统,容易表达一些植物来源的途径合成植物天然产物,如白藜芦醇等。”
在该论文中,该团队特别强调了选择合适的底盘对蓝细菌生物技术的重要性,特别是要考虑产品的性质。比如对于蓝细菌而言,产物浓度是比较大的障碍,如果选择以固体形式存在的聚合物产品,或者与水不溶液体产品作为目标产品,则可避免该问题。
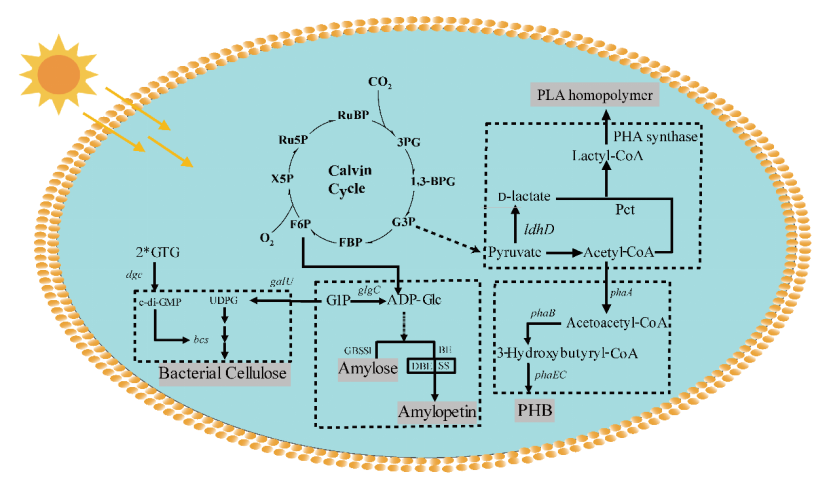
图丨蓝细菌中聚合物合成途径综述(来源:Trends in Biotechnology)
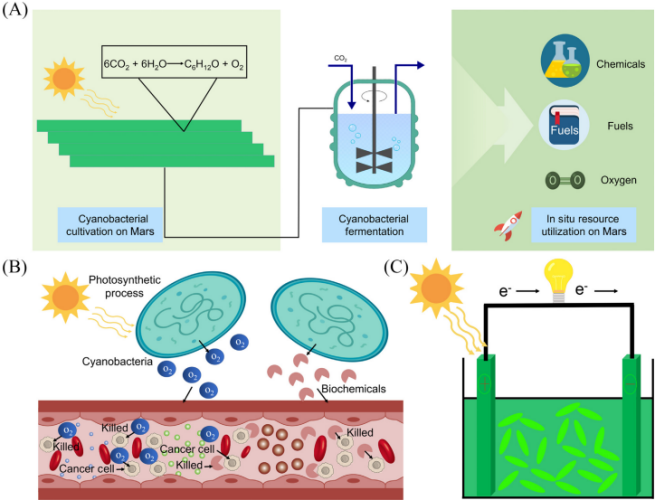
此外,该论文还归纳了很多蓝细菌应用的新方向,如蓝细菌可以应用于生物医药、发电、甚至未来的星际探索等方面。
这些讨论和梳理形成的观点有助于学术界和产业界共同开发新的应用,将蓝细菌的应用价值扩大化。
潜心研究蓝细菌技术 10 余年,提前布局商业化落地
蓝细菌技术的是社会效益和经济效益有机结合的技术,在生产产品的同时可以实现二氧化碳吸收转化,对于减碳、碳中和、节约粮食资源都具有重要的意义。
陶飞所在团队从事蓝细菌方面研究 10 余年,已形成较为成熟的体系。自 2010 年开始,他们先后尝试和实现了多种产品的生产,比如 C3 平台化合物甘油、DHA、乳酸、丙二醇、白藜芦醇等从小分子化合物以及多种芳香化合物的光驱动制造,这些产品也在未来的产业化开发序列中[2-6]。
近期,该团队在光驱动蓝细菌平台上使用代谢工程和高密度培养的组合策略,在国际上首次以二氧化碳为原料,直接合成可降解塑料聚乳酸(Polylactic Acid,PLA)[7]。(相关报道:中国科学家创建新型“光驱动细胞工厂”,实现以二氧化碳为原料的可降解塑料全合成,为材料产业提供“负碳生产”新思路)。
同时,他们在聚合物和聚合物单体的合成方面进行了充分探索,也解决和回答了一些领域内的共性问题,比如提出蓝细菌内核概念,用空间分割理念解决元件适配问题,探索蓝细菌物质代谢可塑性问题等。
图丨合成生物学工具包在生产生物燃料等增值产品的代谢网络重编程中的应用,改造蓝细菌细胞工程来生产有价值的化学品
对于蓝细菌技术的商业化落地,该团队也高度关注,并提前进行了布局。
陶飞认为,蓝细菌技术的商业化最容易在两个方面取得突破。一方面是独特的高值产品。这类产品具有比较高的价值,但只适合用蓝细菌生产,因此产品的市场规模通常比较小。
另一方面是材料类产品。这类产品数量多、市场规模大,同时其成本敏感度比能源产品小,是一种“折中”的产品选择。材料类产品兼具经济和社会效益,是商业化前景比较理想的选择。
“对于蓝细菌技术的产业化落地,我们团队现在的研究重点是对负碳 PLA 技术进行系统地优化,提高产量和效率,然后进行中试放大。”陶飞说。
为了更好地推进技术落地,该团队在上海交通大学的支持下,于今年 5 月成立了创业公司肆芃科技,并已获得天使轮融资。未来,陶飞所在团队将主要围绕提高蓝细菌产品的效率和鲁棒性开展工作,在光能利用效率、碳捕获效率以及代谢网络优化上,争取突破自然进化的局限。
他表示,团队的“终极目标”是把负碳合成生物学技术应用在重要大宗产品的可持续制造。这种技术的最大化应用,有望在生产生活的各个环节中促进减碳和减少污染。
当下合成生物技术高速发展,
蓝细菌的技术瓶颈问题有望得到根本解决
随着 DNA 操作技术的不断进步,最终发展出可以对微生物进行大规模遗传改造的各种技术,比如 CRISPR-Cas9 为代表的基因编辑技术、各种 DNA 组装技术等。这些技术的出现,促进了蓝细菌合成生物学技术的发展。
当前,蓝细菌工业底盘走向工业化,有如下三个方面问题需要解决。
其一是效率问题(生产力低)。该问题是多因素造成的,比如光能利用效率、二氧化碳吸收固定效率、细胞生长速度、载流路径的碳通量等。而这些问题正是合成生物学能够发挥作用的地方。
陶飞指出:“可引入新型细胞色素,甚至使用非生物的纳米技术,来提高光效率和太阳光谱利用率;可通过碳浓缩基因的操作或者使用化学辅助提高碳吸收;通过细胞的改造进化提高生长速度;可用蛋白质工程的方法对关键酶进行改造,如通过先进 AI 工具 AlphaFold2 来改造酶,提高载流路径的效率。”
其二是鲁棒性问题。现在的蓝细菌菌株不够稳定,耐受生物和非生物因素的影响方面的能力较弱。通过合成生物技术引入抗逆的基因和基因线路,可以提高蓝细菌菌株耐高光、抗杂菌污染、耐盐等方面的能力。而且,还能实现蓝细菌菌株对多种不良因素的耐受能力。“这方面的工作对于蓝细菌技术的工业化会有较大的帮助。”他说。
其三是反应器问题。蓝细菌技术工业化,特别是要形成规模化产能,其中一个非常重要的环节就是反应器。比如蓝细菌的高密度培养是提高其生产力的重要因素,这就需要反应器的辅助。
蓝细菌的培养不同于传统的发酵,它需要光和二氧化碳,涉及电光转换、光传导、气液传质等各种各样的问题,这些需求增加了反应器的复杂性。
他表示,这是蓝细菌进行工业化的挑战,也是光反应器设计开发的机遇。传统生物反应器的简单改造不能适配用于光合微生物细胞培养,需要专门去设计和建造,同时满足大规模、低成本、高效率的需求。
对于蓝细菌的技术瓶颈难题,陶飞持乐观态度,他说:“当前时期是合成生物技术高速发展的阶段,尤其是 AI 技术和高通量技术的加持,会推动蓝细菌技术更快地发展。很多蓝细菌的技术瓶颈问题,也有望在未来得到根本解决。”
图丨蓝细菌应用的新趋势
那么,我们距离将蓝细菌“种植”的材料走向太空,甚至用蓝细菌改造火星还有多远呢?
火星是离人们最近的类地行星,有水和大气,但是却没有氧气。公开资料显示,“火星大气中超过 95.3% 都是二氧化碳,还有 2.7% 是氮气。”
陶飞表示,“如果人们具备在火星上培养蓝细菌的能力,那便可通过阳光、水、二氧化碳让蓝细菌生存,并产生大量氧气和有机物。”
目前,已有研究人员模拟火星环境,并成功培养蓝细菌。这说明,利用蓝细菌改造火星大气是可能的。当然,真要在火星上种植蓝细菌,还需要做很多研究,比如蓝细菌在火星的培养问题,相关的工业化设备在火星建造的问题等。
当然,外星探索是一个系统工程,改造星球更加宏伟,这些需要综合考虑,不是仅靠生物学家就能解决的。陶飞认为,“这需要一个契机,如果能够把合适的蓝细菌送上火星,我们有信心能让蓝细菌为星际旅行和行星改造工作。”
展望负碳生物学的未来发展,他表示,该领域机遇与挑战并存,需要科学家、工程师、企业家以及政府等全社会的力量共同努力,希望未来有幸能和有兴趣的志同道合的伙伴共同合作。
参考资料:
1.Tan, C.L. et al. Carbon-negative synthetic biology: challenges and emerging trends of cyanobacterial technology. Trends in Biotechnology(2022).https://doi.org/10.1016/j.tibtech.2022.09.012
2.Wang, Y. et al. Production of C3 platform chemicals from CO2 by genetically engineered cyanobacteria. Green Chem. 17, 3100–3110 (2015).https://doi.org/10.1039/C5GC00129C
3.Liu, H., Ni, J., Xu, P. & Tao, F. Enhancing Light-Driven 1,3-Propanediol Production by Using Natural Compartmentalization of Differentiated Cells. ACS Synth Biol 7, 2436-2446 (2018).
4.Li, C. et al. Enhancing the light-driven production of D-lactate by engineering cyanobacterium using a combinational strategy. Sci. Rep. 5, 9777 (2015).https://doi.org/10.1038/srep09777
5.Ni, J., Liu, H.Y., Tao, F., Wu, Y.T. & Xu, P. Remodeling of the Photosynthetic Chain Promotes Direct CO2 Conversion into Valuable Aromatic Compounds. Angewandte Chemie 57, 15990-15994 (2018). https://doi.org/10.1002/anie.201808402
6.Ni, J., Tao, F., Wang, Y., Yao, F. & Xu, P. A photoautotrophic platform for the sustainable production of valuable plant natural products from CO2. Green Chem. 18, 3537-3548 (2016). https://doi.org/10.1039/C6GC00317F
7.Tan, C.L. et al. Direct carbon capture for the production of high-performance biodegradable plastics by cyanobacterial cell factories. Green Chem. 24, 4470–4483(2022). https://doi.org/10.1039/D1GC04188F