作者
汪生,杭太俊
安徽医科大学科研实验中心
中国药科大学药物分析系
摘要
基因毒性杂质危害性大,需要严格控制其在药物中的限度,保障用药安全。基因毒性杂质的检测面临杂质种类多和化学性质活泼等问题,分析方法复杂多样,从而对药物中基因毒性杂质的检测方法提出了很高的要求。
本文从基因毒性杂质的研究思路、来源、分类、限度、检测方法和研究难点6 个方面进行总结分析,为药物中基因毒性杂质的检测提供借鉴。
关键词
基因毒性杂质; 来源; 分类; 限度; 检测方法
正文 |
影响药品纯度的物质被称为杂质,药品中的杂质一般没有治疗作用,有的会影响药物的稳定性和疗效,甚至导致不良用药事件的发生[1-3]。
药物中杂质来源主要有两方面:
① 在药物的生产过程中引入。
②由储藏或运输过程中受到外界条件的影响,导致药物理化特性发生变化而产生[4]。
Ashby 等[5]在研究了300 多种化合物对DNA活性影响研究的基础上,首次提出了基因毒性的概念。
基因毒性杂质( genotoxic impurity,GTI) 定义为“经过适当遗传毒性实验模型,如细菌基因突变( Ames) 实验,证实具有遗传毒性的杂质”。
该类杂质可能从基因突变、染色体畸变、DNA 损伤与修复等几个方面同DNA 发生直接或间接的相互作用,从而改变DNA 结构与构象或引起DNA 的损伤,进而影响DNA的功能或改变其遗传特性,最终引起突变、癌变、畸变等遗传毒性[6-8]。
关于药物中基因毒性杂质超标导致药品召回的事件均有报道,各国药品监督管理部门对药物中基因毒性杂质的控制出台了一系列的指导文件,旨在严格控制该类杂质在药物中的限度。
本文从基因毒性杂质的研究思路、来源、分类、限度、检测方法和研究难点6 个方面进行分析和总结,为该类杂质的研究提供一定的理论依据和参考。
1
基因毒性杂质的研究思路
将药物中的基因毒性杂质完全除去实际操作难度很大,ICH,EMA 和FDA 均颁布了相关的基因毒性杂质控制指导文件,推荐以毒理学关注阈值( threshold of toxicological concern,TTC,1.5 μg·d-1 )来控制用药风险。
TTC 具体含义为在人的一生( 70岁) 中,每天摄入1.5 μg 基因毒性杂质,其致癌的风险是可接受的( < 1 /100 000) 。
所以在实际的检测中,基因毒性杂质采用限度检查的方法。药物中基因毒性杂质的具体研究思路如下:
① 根据药物合成工艺中使用的起始物料、试剂和催化剂等,结合可能发生的化学反应推测药物中可能引入的基因毒性杂质并对其进行分类。
② 确定杂质可接受的最大限度。
③ 开发药物中基因毒性杂质的检测方法。
④ 建立专属性强、稳定性好、灵敏度高、分析速度快的分析方法,并进行方法学验证。
⑤ 对供试品进行测定,确认样品中基因毒性杂质的限度是否符合要求。
根据研究思路、待测物的性质和各种检测手段的特点,总结出基因毒性杂质的研究决策树[9],见图1。
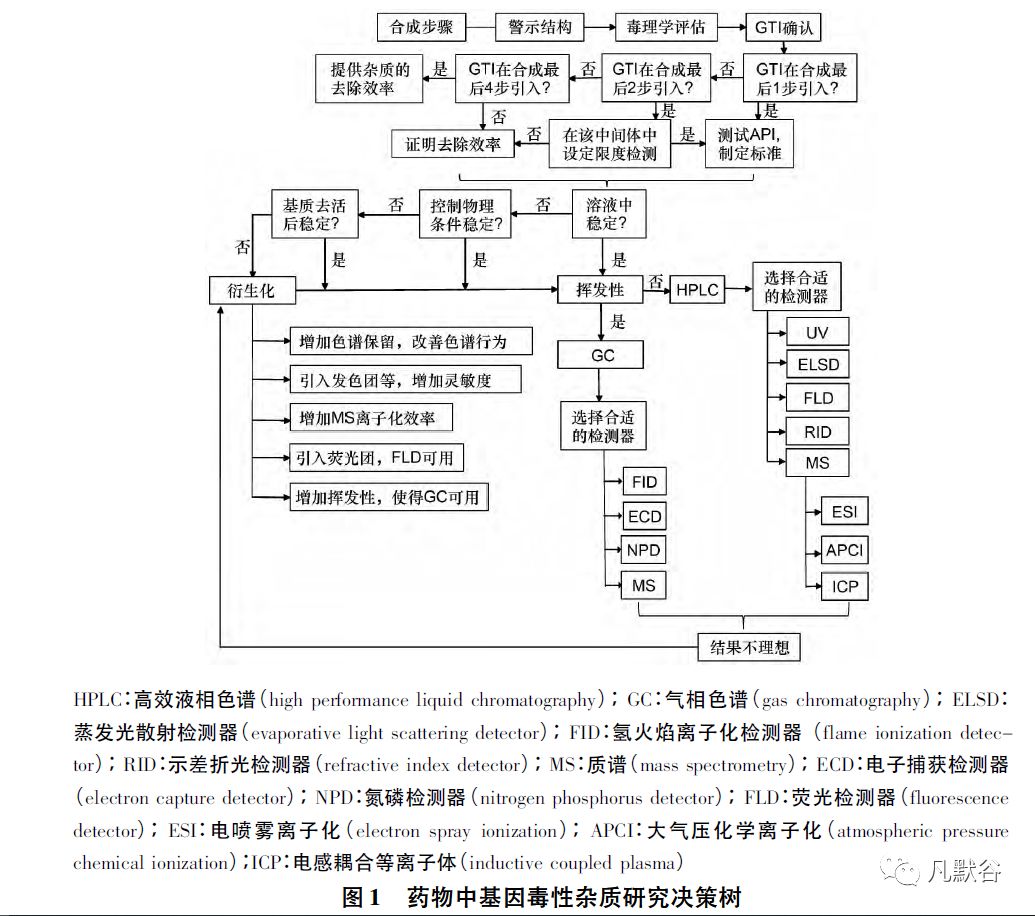
2
基因毒性杂质的来源
药物中基因毒性杂质的来源有原料药合成的起始物料、反应中间体、催化剂和试剂等。
此外,在药物的合成、制剂生产、储存或运输过程中也会生成基因毒性杂质[10],所以药物中基因毒性杂质的来源贯穿药品的生产和流通整个过程。
本文将药物中基因毒性杂质的来源分为3 类[9]:
① 基因毒性试剂( genotoxic reagents) : 药物在合成过程中使用的原料、反应试剂或催化剂,其本身具有警示结构,在合成反应过程中未反应完全而引入到中间体或药物粗品中。
② 基因毒性合成产物( genotoxic synthetics) :在药物的合成过程中,2 个或多个合成物料或试剂在一定化学反应条件下生成具有警示结构的杂质,该类杂质可能是副产物也可能是药物合成中间体。
③ 基因毒性降解产物( genotoxic degradants) : 原料药或制剂本身不具有警示结构,但在储存或运输过程中发生氧化或还原等反应,最终生成具有警示结构的杂质。药物中基因毒性杂质的来源示意图和举例分别见表1 和图2。
基因毒性杂质申报资料的监管已经得到药监部门的重视,FDA,ICH,EMA 和CFDA 均对药品申报文件中有关基因毒性杂质的控制提出严格的要求。
3
基因毒性杂质的分类
为确定某种物质是否具有基因毒性,目前主要通过毒理学评估手段,以体外Ames 实验为主,辅以部分体内实验进行补充[11]。
自然界中化合物的种类成千上万,对药物合成过程中所涉及的化合物均进行毒理学评价,判别它们是否为基因毒性杂质的方法成本高、周期长,在实际研究工作中难以开展。
通过化学物质的结构与毒理学活性相关方面的研究,某些官能团或者亚结构单元,能与生物体内一些功能性的大分子发生反应,引起基因突变,这些官能团或者亚结构单元对生物活性具有警示作用,统称为“警示结构”[12]。
在研究中利用这种“警示结构”来判断化合物是否具有基因毒性,使得药物中基因毒性杂质的确定更迅速、研究更具有针对性,极大方便了药物中基因毒性杂质的研究工作。
Ashby 等[13]总结了一些易致癌化学物质的结构单元,并提出了具有18 种警示结构的化合物模型即“超级致癌物”,见图3。
EMA 和FDA 指南都认为使用结构评估是研究药物中基因毒性杂质的一种有效的方法,常用的结构评估商业软件有DEREK 和Mcase 等,也可以使用基于Ashby 和Tennant 简单的警示系统[14],结合相关资料和研究,将警示基团分20 类列出,见表2。
FDA 还推荐使用MC4PC 等软件对化合物进行结构评估,以对化合物的毒性进行更准确的衡量,对药物中基因毒性杂质研究提供参考[15]。
如果杂质没有被基因毒性标记,但在工艺中作为亲电试剂使用,仍需要通过数据库查询确定其是否具有基因毒性,如美国医学图书馆的TOXNET 数据库等,其提供了许多常见化学品的安全性数据[14]。
应当注意,含有警示结构并不意味着该物质一定具有遗传毒性,而确认有遗传毒性的物质也不一定会产生致癌作用。
物质的理化性质和其结构特点(如相对分子质量、亲水性、分子对称性/空间位阻、反应活性以及生物代谢速率等) 可能会对其毒性产生抑制或调节作用。
警示结构的重要性在于它提示了可能存在的遗传毒性和致癌性,为杂质进一步的安全性评价和控制策略的选择指明方向[16-18]。
4
基因毒性杂质的限度
2004 年EMA 发布的基因毒性杂质限度指南( 草案) ,采用“最低合理可行”的概念,默许全面消除风险是无法实现的,因此建议采用毒理学关注阈值TTC 作为基因毒性杂质的可接受限度[16]。
TTC概念的应用允许在无任何体内数据时,在足够的安全性基础上建立杂质控制限度。
TTC 的应用有利于企业和监管机构,使其避免做不必要的毒理学研究和安全性评估。
然而,该草案没有明确短期临床试验的允许限度,在某些短期临床研究中,也被迫接受TTC 的终生暴露限值。
因此,在行业发展的要求下,“阶段化TTC”概念也应运而生[19]。
美国药物研究和制造商协会在2006 年开发了一套基因毒性杂质检测、分类、界定和独立风险评估的程序。
根据积累剂量定义暴露风险的原则,提出了阶段化TTC 概念,见表3 和表4。
有些物质的结构基团被识别为具有较高的效价,即使摄入量低于TTC 水平,从理论上来说仍可能会导致显著癌症风险。
基于上述这些原因,应进行风险评估来决定是否需要采取进一步行动。
根据诱变性和致癌性,可将杂质分为5 类,见表5 所示[16,18]。
在药物基因毒性杂质的研究中,确定杂质的个数和种类后,需计算其在药物中的可接受限度,具体计算方法参考表5。
药物的生产过程中可能会涉及多个基因毒性杂质,因此在计算杂质限度时,还应注意以下2 点原则[20]:
① 多个基因毒性杂质存在于原料药中,只要杂质结构( 指警示结构) 不相关,1.5 μg·d-1 的TTC 限度可应用于单个杂质。
② 在原料药中存在一个以上的基因毒性杂质时,1.5 μg·d-1 TTC 值对每一个结构不相关的杂质是适用的。
在结构相似的情况下,基因毒性杂质的作用模式可能一致,并具有相同的分子靶向,在这种情况下,建议该类基因毒性杂质的总和为1.5 μg·d-1。
杂质的限度明确后,就需要确定杂质分析的限度测试浓度,包括选择适宜的分析仪器和样品处理方法。
确定好分析方法后就需要对方法进行优化以及方法学验证。
5
基因毒性杂质的检测方法
基因毒性杂质的化学结构种类繁多,如何针对特定的基因毒性杂质选择最合适的分析方法是药物中基因毒性杂质研究的重点和难点。
总结基因毒性杂质分析研究中各种分离方法和检测器的特点[21],见表6,为药物中基因毒性杂质分析方法选择提供参考。
基因毒性杂质种类繁多,且在药物中含量低、结构差异大,故针对不同的待测物选择不同的样品前处理方法。
如何提高检测方法的灵敏度和专属性,是药物中基因毒性杂质研究的重点和难点。
基因毒性杂质检测方法聚焦在如下3 个方面:
① 选择先进的分析仪器,如GC-MS,LC-MS 等方法: 质谱检测器的高灵敏度适用于微量或痕量物质的检测,而且专属性好。
② 采用衍生化技术: 衍生化方法增加基因毒性杂质的稳定性或者生成易检测的衍生化产物,提高分析检测的灵敏度。
③ 基质钝化: 采用萃取或SPE 等方法,除去大部分基质以减小对待测物的干扰,同时达到富集待测物的目的,提高分析方法的灵敏度。
根据相关法规和文献报道,总结药物中常见的基因毒性杂质的处理方法供参考[18,22-27],见表7。
一个药物中可能含有多种基因毒性杂质,这就可能需要建立多种检测方法对其分别进行测定,多种检测方法的结果相互佐证。
6
基因毒性杂质的研究难点和问题
针对基因毒性杂质限度低、结构多样、化学性质活泼等特点,研究面临诸多难点,主要表现在如下几个方面。
① 基因毒性杂质的种类多,理化性质差异大。针对某一个药物中基因毒性杂质的检测可能需要开发多个研究方法,各方法的研究结果相互补充,以满足测定要求。
② 基因毒性杂质的稳定性差的问题。基因毒性杂质多含有活泼的官能团,易和介质等发生反应或自身容易发生氧化、还原或分解反应等,在样品分析过程中可能需要加入稳定剂或者衍生化解决稳定性的问题。
③ 基因毒性杂质的限度较低。在检测中通常会配制高浓度的供试品,以达到设定的检测限。
在液质方法检测中,高浓度的供试品可能析出、堵塞色谱柱、污染离子源、基质效应以及干扰待测物出峰等问题,增加检测的难度。在实际研究中可以改变溶剂组分让供试品析出或SPE 等其他方法,将高浓度的基质除去。
在设定液质条件时,还可以将主成分的色谱峰切出质谱。
④ 药物在降解过程产生的基因毒性杂质检测难度大,相关的报道也少,降解产物基因毒性杂质应该得到有关方面的关注。
⑤ 溶解性问题。一般供试品的浓度高,选择合适的溶样液体系,使得潜在的基因毒性杂质完全溶解,确保检出结果的可靠性; 基因毒性杂理化性质差异大,在实验初期,要选择合适的溶剂,使得对照品完全溶解,同时溶剂对待测物无干扰。
溶剂还可能影响到待测物的稳定性。
⑥ 一些未知物质给测定带来不确定的影响。
某些药物其光学异构体具有基因毒性,对于制剂里面异构体检测可采用正相色谱,通常要通过富集和衍生化,去除辅料的干扰,提高检测的灵敏度。
⑦ 基因毒性杂质的限度低。一般需要使用液相质谱或者气相质谱联用技术,质谱检测方法作为药品的日常检测对于企业来说增加了成本。
⑧ 企业对药物工艺路线中涉及的基因毒性杂质来源评估不全面。
没有全面考虑起始物料、试剂、溶剂等可能带入的基因毒性物质,对工艺过程中可能产生的基因毒性杂质也没有充分评估等。
7
讨论
药物中基因毒性杂质由于限度要求低和化学性质活泼等原因,使得测定方法要有较高的灵敏度,一般将衍生化或SPE等样品处理方法同液质和气质检测仪器结合起来。
药物中基因毒性杂质的限度检查研究关注药物中痕量的毒性杂质,拓宽了药物的质量控制范围,为药物的临床应用安全性提供保障。









