复星凯特的阿基仑赛;药明巨诺的瑞基奥仑赛注射液获批上市了。因为生产运输各环节成本高,所以会产生巨额治疗费用,其疗效也更为人们所期待。
二者都是CD19-CAR-T,目前临床相对积累了较多经验。在众多引起治疗失败的因素中,anti-CD19 CAR的细胞免疫反应是其中之一。
anti-CAR可以清除CAR-T细胞
2010年,在第一代自体CD19 CAR-T治疗中,2例滤泡型淋巴瘤患者体内,CAR-T未能持续1周。重新输注更高剂量和同时使用IL-2,CAR-T细胞在体内也无法存活。究其原因,除了制造工艺之外(第一代CAR鼠源成分较高),第一次输注引起的对CAR-T细胞CAR或者自杀基因HyTK的细胞免疫,导致了第二次输注细胞无法存活。
第一代和第二代CAR-T中使用小鼠的scFvs的CAR时, 发生anti-CAR免疫反应,则CAR+ 细胞数量减少,将scFvs替换为人源scFvs则可消除(文献2)。
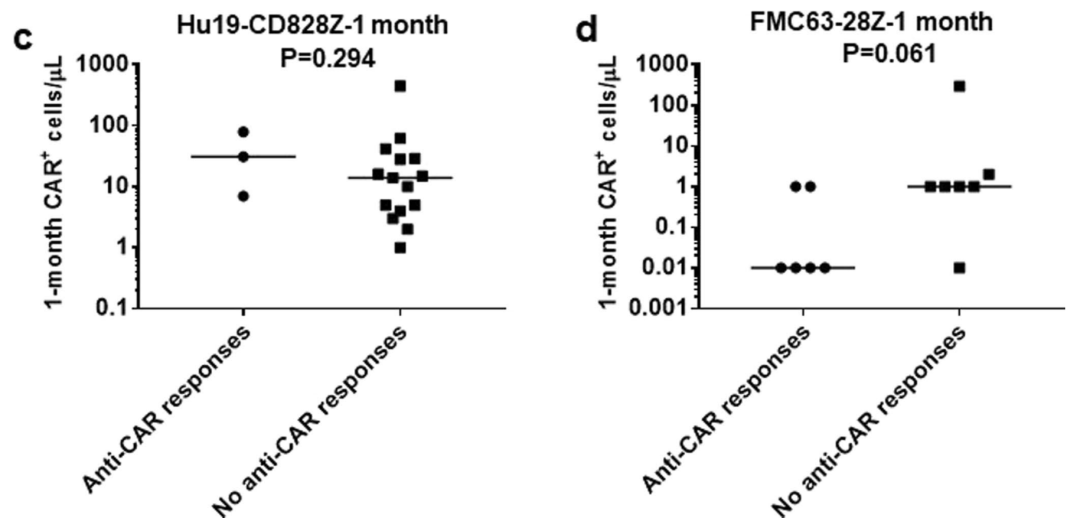
注:Hu19-CD828Z使用人scFvs,FMC63-28Z使用小鼠scFvs
使用环磷酰胺和氟达拉滨进行清淋,可以降低抗CAR细胞免疫。
尽管CAR-T临床应答率很高,但是约30-50%的患者在12个月内疾病复发(抗原缺失逃逸是一个机制)。但是重新输注原始的CD19 CAR-T细胞,临床反应并不理想,完全缓解通常低于25%,现在认为与第一次输注引起的anti-CAR免疫反应相关。
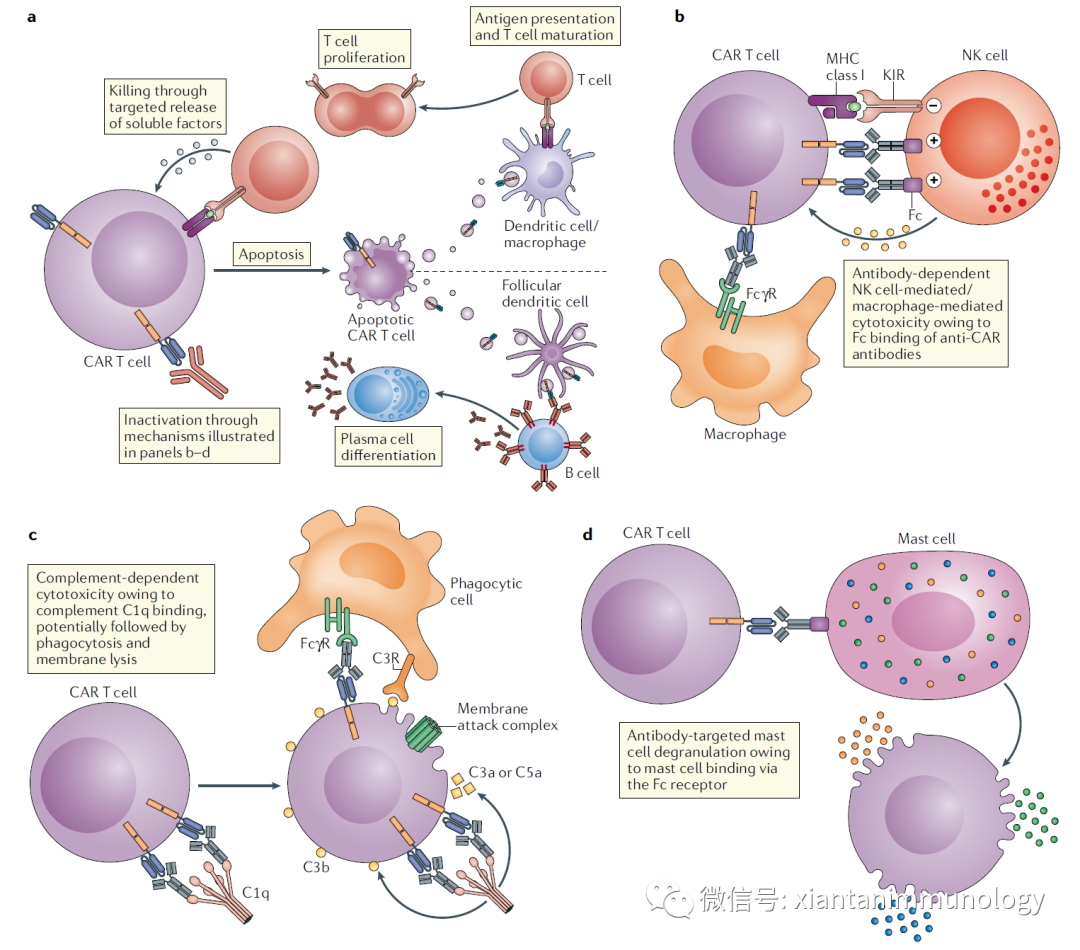
Anti-CAR免疫的四个机制
Nat Rev Clin Oncol . 2021 Jun;18(6):379-393.
获得性免疫
针对CAR-T细胞的获得性免疫包括细胞免疫和抗体介导的体液免疫。
凋亡或者坏死CAR-T细胞释放的抗原被APC细胞(树突状细胞和巨噬细胞)递呈给T细胞,T细胞活化、增殖,进而释放颗粒酶,穿孔素等,杀伤CAR-T细胞,进一步释放抗原,形成正反馈,最终导致CAR-T被清除。
ADCC和ADCP
B细胞释放的anti-CAR抗体Fc段与表达FcR的免疫细胞相互作用,通过自然杀伤细胞,释放穿孔素,颗粒酶等,裂解CAR-T细胞。或者通过巨噬细胞,通过ADCP介导对CAR-T细胞的吞噬。
补体依赖的细胞毒性
Anti-CAR抗体结合CAR形成免疫复合物,进而结合补体C1q, 引起补体的级联激活,形成膜攻击复合体等,最终裂解CAR-T细胞或者吞噬CAR-T细胞。
肥大细胞介导的细胞毒性
抗CAR-IgE也可以与肥大细胞的FcR结合,从而促进脱颗粒和CAR-T细胞死亡。肥大细胞肉芽中多种血管活性介质的过度释放可导致全身过敏反应,曾导致患者死亡(文献4)
三个降低免疫原性的策略
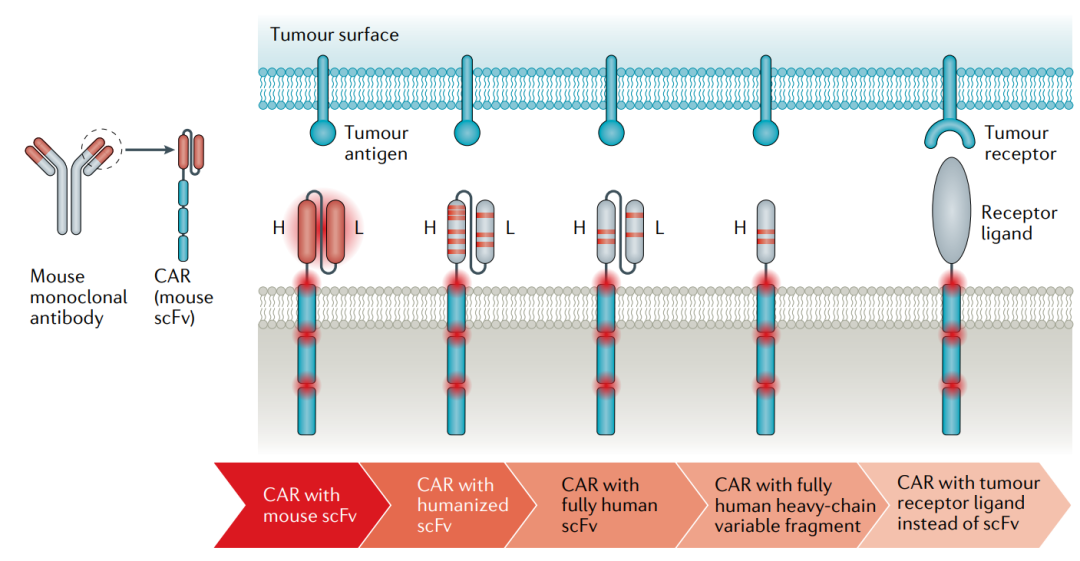
scFv的人源化
scFv含有鼠源序列,是产生anti-CAR免疫反应的重要因素。抗体人源化技术的发展提供了解决方案。对于使用鼠源scFv CAR-T复发的患者,使用人源scFv CAR-T是一个不错的策略。
但是理论上,全人源抗体也可以产生抗独特型抗体的免疫反应,目前还没有直接的临床数据。
直接比较小鼠源性和人源化scFvs的免疫原性的头对头临床试验是必要的。
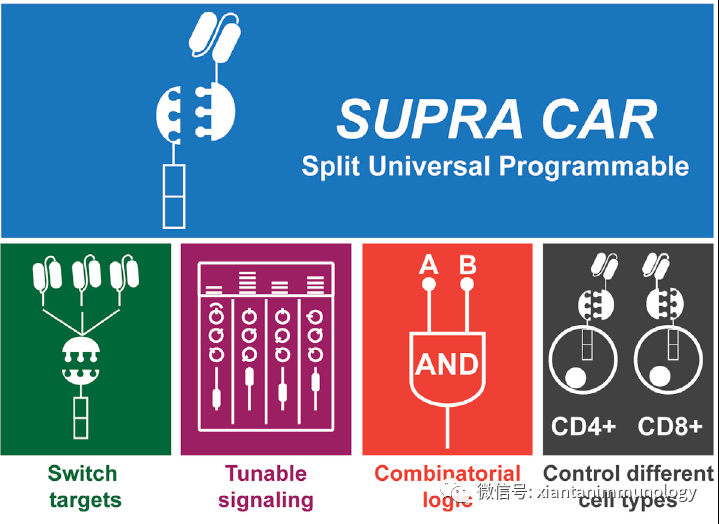
使用配受体结合代替scFv和靶抗原结合
肿瘤细胞也可以通过内源性肿瘤特异性受体-配体相互作用被靶向,内源性的配受体被认为是自身成分。
SUPRA CAR (Cell 173, 1426–1438.e11 (2018))
然而,到目前为止还没有关于使用这种通用受体策略的免疫原性数据。
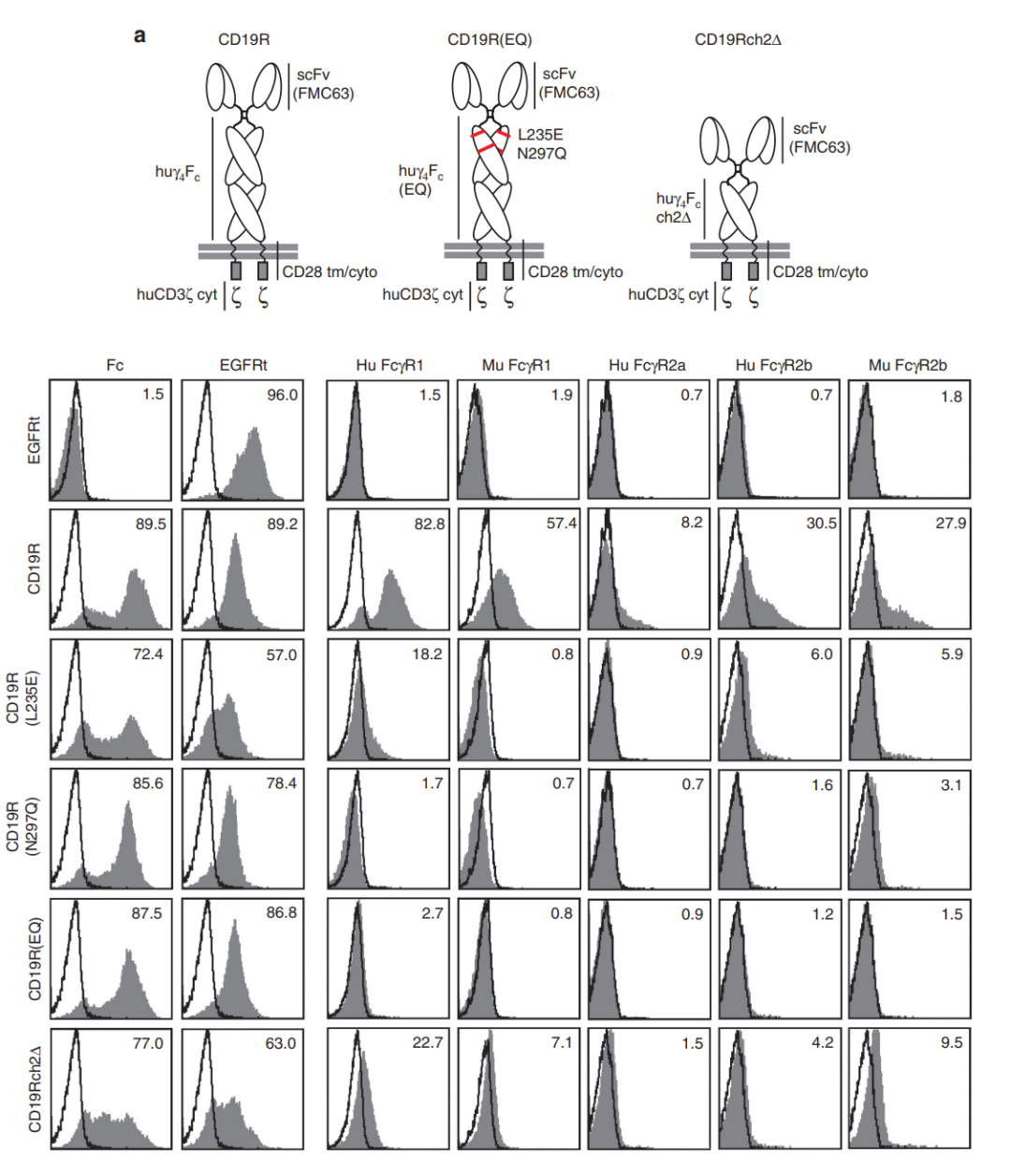
Spacer突变
IgG衍生的间隔区,CH2和CH3结构域可以与先天免疫细胞上的Fc受体结合,包括巨噬细胞、粒细胞和自然杀伤(NK)细胞等,并可能构成免疫原性风险。
事实上,有研究显示包含CH2结构域的Fc结合间隔区的存在,可能导致CD19靶向CAR-T细胞持久性较差。这种现象可以通过突变间隔区内的Fc受体结合表位来避免,从而阻止先天免疫细胞的激活。
间隔区突变降低FcR结合(Mol. Ther. 23, 757–768 (2015))
简评:免疫原性无处不在,合理规避,至关重要。