国产妥布霉素滴眼液质量评价
来源
中国抗生素杂志 2019年3月第44卷第3期
作者
于明艳 耿雪 张乃斌 张冬梅 李玉杰 祝清芬 凌霄
山东省食品药品检验研究院
摘要
目的 :
综合评价妥布霉素滴眼液的质量现状。
方法:
采用现行法定标准结合探索性研究对市场上21家生产企业的174批妥布霉素滴眼液的质量进行系统比较,通过对有关物质、杂质谱分析及抑菌剂合理使用,分析不同企业产品妥布霉素滴眼液的质量差异。
结果:
法定标准检验174批妥布霉素滴眼液1批不合格,合格率为99.4%;探索性研究揭示现行标准中有关物质检查方法需进一步提高,同时发现部分企业抑菌剂使用不合理。
结论:
国内妥布霉素滴眼液整体质量一般,质量标准有待统一和提高。
关键词
妥布霉素滴眼液;质量分析;有关物质;
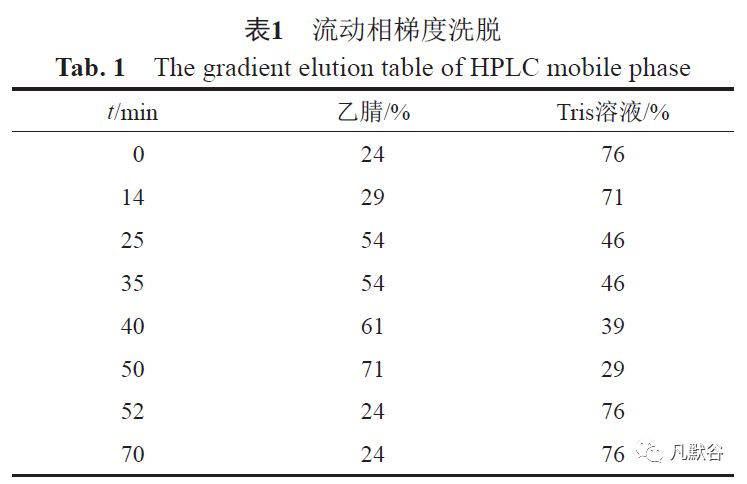
正文 抑菌剂妥布霉素属于氨基糖苷类抗生素,能够在细菌核糖体30S和50S亚基的联结位置联结,阻碍70S复合物的形成,使mRNA不能翻译成蛋白质,导致细菌死亡。 主要对革兰阴性菌,如铜绿假单胞菌、大肠埃希菌、克雷伯菌、变形菌、柠檬酸杆菌有效。 临床主要用于结膜炎、角膜炎等眼部细菌感染,特别是对庆大霉素耐药的革兰阴性菌感染,如严重的铜绿假单胞菌感染有效[1-3]。 妥布霉素滴眼液于1981年3月15日由美国爱尔康公司研究上市,商品名“TOBREX”。 其主要用于敏感细菌所致的外眼及附属器的局部感染。 不良反应主要表现为偶见局部刺激症状,不宜与其他肾毒性或耳毒性药物合用或先后应用[4-5]。 国内生产企业共31家,批准文号37个;国外在华注册企业1家,进口批准文号1个,规格均为0.30%(3mg/mL)。 按装量标示,有5、8、9、10和0.4mL的包装规格。 目前仅中国药典二部及美国药典(USP)41收载妥布霉素滴眼液[1,6]。 2018年国家评价性抽验共抽取到174批次妥布霉素滴眼液,旨在客观地评价国内药品的质量现状,分析产品的主要质量问题,进而明确产品质量提高的方向。 本文依据现行药品质量标准的检验结果结合探索性研究,对国内市场上的妥布霉素滴眼液产品质量进行了系统性分析研究,并提出对现行药品标准改进的建议。 1 仪器与试药 1.1 仪器 岛津LC-20AT高效液相色谱仪(DAD检测器);Q ExactiveTM超高效液相色谱-质谱联用系统;Agilent 7890气相色谱仪-7697顶空进样器;MassFrontier 7.0软件(Thermo Fisher Scienific, MA, USA);Mettler MS105DU电子天平;二氧化碳培养箱(德国Memmert公司);高压蒸汽灭菌器(日本Sanyo公司);酶标仪(美谷生物);MJ-250I霉菌培养箱;GHP-9270隔水式恒温培养箱(上海一恒科技有限公司)。 1. 2 试药 妥布霉素对照品:批号:130527-200402,含量:91.4%,购自中国食品药品检定研究院; 新酶胺对照品:批号:130411-200908,含量:100%,购自中国食品药品检定研究院; 卡那霉素B对照品:批号:130548-200501,含量:100%,购自中国食品药品检定研究院; 尼泊拉胺对照品:批号:10-RAJ-168-2,含量:95%(硫酸盐形式),购自Toronto ResearchChemicals(TRC); 脱氧链酶胺卡那胺对照品(杂质D、妥布霉素A):批号:9-KPA-46-1,含量:97.95%,购自TRC; 苯扎溴铵:批号:135051-201401,10.9mg/mL,购自中国食品药品检定研究院; 苯扎氯铵:批号:1300549-201504,12.19mg/mL,购自中国食品药品检定研究院; 羟苯乙酯:批号:100847-201604,含量:99.9%,购自中国食品药品检定研究院; 羟苯丙酯:批号:100444-201403,含量:99.6%,购自中国食品药品检定研究院; 硫柳汞钠:批号:143172,含量:96.6%,购自Dr.Ehrenstorfer GmbH C 17515000; 乙腈(Merck)、乙醇(科密欧)、二甲基亚砜(科密欧)、均为色谱纯;三羟甲基氨基甲烷购自国药,批号:20160907,含量≥99.0%; 2,4-二硝基氟苯:购自Tokyo ChemicalIndustry(TCI),批号:68XD2378,含量>99.05%; DPBS缓冲液,批号:20180712,购自Hyclone公司;MTT,批号:MKBL3665V,购自Sigma-Aldrich公司; 异丙醇,批号:20160928,购自天津市康科德技术有限公司; 组织培养液B,批号:20180831,购自广东博溪生物科技有限公司。 Bio OcullarTM RHE三维角膜模型,批号:OT180803,购自广东博溪生物科技有限公司铜绿假单胞菌[CMCC(B)10104] 3-20180709-2、金黄色葡萄球菌[CMCC(B)26003] 3-20180712-2、大肠埃希菌[CMCC(B)44102] 3-20180630-1、黑曲霉[CMCC(F)98003] 3-20180713-2;白念珠菌[CMCC(F)98001] 3-20180619-1,以上菌种购于中国食品药品检定研究院医学菌种保藏中心,工作菌种为第三代。 胰酪大豆胨琼脂培养基(批号:172441)、沙氏葡萄糖琼脂培养基(批号:172401)均购于广东环凯微生物科技有限公司; 氯化钠(批号:20171030)购于国药集团化学试剂有限公司。妥布霉素滴眼液174批次均为2018年国家计划抽验样品,来源于21家生产企业。 2 试验方法 2.1 法定检验 根据各厂家药品批准文号信息, 按2015年版中国药典或国家食品药品监督管理局标准(YBH02042016/YBH08652009/YBH17182006)进行法定检验。 2.2 探索性研究 根据法定检验结果,结合文献检索情况,围绕着药品安全性、有效性和质量标准的可控性,进一步开展杂质谱分析、有关物质、抑菌剂眼刺激性、抑菌效力等项目的探索性研究。 2.2.1 杂质谱分析 色谱条件:A g i l e n t Z o r b a x S B -C18柱(4.6mm×250mm, 5μm);流动相:10mmol/L三氟乙酸;柱温:40℃;流速:0.5mL/min;进样量:10μL。质谱条件:质谱采用加热ESI源,正/负离子模式。 加热ESI离子源参数如下:毛细管电压:3200V(正负离子模式)喷雾电压为3.0kV,毛细管温度和雾化器分别为350和250℃。 鞘气和辅助气分别设为275.58和103.4kPa, S-lens RF电压为50V。 喷雾气和碰撞气均为氮气。 扫描方式采用正离子Full MS/dd-MS2模式,此模式包含1次一级全扫描(分辨率70000FWHM)和1次数据依赖的二级扫描(分辨率17500FWHM)2个事件。 一级全扫描范围为m/z 100~1000,自动增益控制(AGC)和离子注入时间(IT)分别设为1.0e6和100ms;数据依赖的二级扫描(dd-MS2)AGC设为2.0e5,最大IT设为50ms,观察窗(isolation window)设为1.0m/z,未充满系数(underfillratio)设为1.0%,强度阈(intensity threshold)设为4.0e4,同位素排除(exclude isotopes)设为“on”,动态排除(dynamic exclusion)设为10.0s;碰撞模式:高能量碰撞解离(HCD);碰撞能量:NCE30,递增率(Stepped)NCE 50%。 2.2.2 有关物质测定 色谱条件:乙腈和三羟甲基氨基甲烷(简称Tris)溶液(取Tris2.0g加水溶解稀释至800mL,加入1mol/L硫酸溶液20mL)作为流动相,进行梯度洗脱,见表1。
流速:1.2mL/min;检测波长:254nm;进样量20μL分别注入液相色谱仪,记录色谱图。 衍生化处理方法:量取待衍生溶液适量,置于50mL容量瓶中,加水2mL 2,4-二硝基氟苯溶液10mL、三羟甲氨基甲烷试溶液10mL,摇匀,盖上塞子,置于60℃水浴中加热50min,取出,加乙腈至离刻度约2cm处,冷却至室温,加乙腈至刻度,摇匀,即得。 2.2.3 抑菌剂眼刺激性 采用3D角膜上皮模型来评价不同抑菌剂的眼刺激反应。3D角膜上皮模型以人角膜上皮细胞为种子细胞,通过精细调节培养液成分,使细胞在体外分化形成3D角膜组织。 具有与人角膜上皮高度相似的结构与功能。 该评价模型采用人源的角膜上皮模型与受试物相接触,通过给药后MTT细胞活性检测方法测得模型ET50值,评估不同样品的体外眼刺激性[7-8]。 受试物采用的试验浓度为表2所示。 2.2.4 抑菌效力考察 将21家企业的产品按照中国药典2015版通则[1121]抑菌效力检查法进行抑菌效力的考察。 3 结果及讨论 3.1 法定检验 174批次妥布霉素滴眼液依据现行质量标准检验,173批次符合规定,1批次检查项羟苯乙酯不符合规定,合格率99.4%。 该不合格批次产品生产日期为2017年4月。 经分析,其不合格原因为:(1)羟苯乙酯在碱性条件下不稳定,该企业生产工艺中PH调节值高于大部分企业;(2)羟苯乙酯放置易降解,该不合格批次生产时间为2017年4月,属于货架末期产品;(3)经调研其他企业多为高限投料,以保证货架期产品羟苯乙酯检查符合规定,该不合格批次生产企业羟苯乙酯投料量不能保证在效期内降解后羟苯乙酯检查合格。 3.2 现行质量标准发现的问题 本次评价的妥布霉素滴眼液不同生产企业添加的抑菌剂种类不同。 添加的抑菌剂涉及苯扎氯铵、苯扎溴铵、羟苯乙酯、羟苯丙酯、硫柳汞钠。 其中硫柳汞钠中含有汞,在人体中会有残留富集作用,同时对眼表损伤较大,不建议作为抑菌剂在眼用制剂中使用。 在标准检验中发现一家企业使用硫柳汞钠作为抑菌剂。现行质量标准杂质谱控制不全面。 妥布霉素为发酵来源的抗生素,在发酵过程中易产生与其结构类似的杂质。现行标准仅控制单个杂质及其他各杂质的和,对特定杂质没有控制,无法评价不同企业产品间的杂质谱的不同,进而反映不同企业产品的质量差异。 3.3 杂质谱分析 采用Q-Exacive Plus高分辨液质对不同生产企业的产品进行分析。 发现各生产企业的产品杂质谱TIC一致,获得一级离子丰度较高的4个杂质,其[M+H]+分别为324.1765、323.1925、484.2613和307.1976。 采用MassFrontier软件推测4个杂质可能为脱氧链霉胺卡那胺、尼泊拉胺、新霉胺和卡那霉素B。 本研究通过购买获得了上述杂质对照品,用Q-Exacive Plus高分辨液质对杂质对照品脱氧链霉胺卡那胺、新霉胺、卡那霉素B、尼泊拉胺进行分析。 将杂质对照品一级二级质谱与妥布霉素滴眼液样品中丰度较高的4个杂质的一级二级质谱进行对比,确认4个杂质分别为脱氧链霉胺卡那胺、尼泊拉胺、新霉胺和卡那霉素B,杂质结构及信息见表3。 3.4 有关物质研究 参照进口注册标准JX20100135色谱条件及柱前衍生的方法,采用的衍生化试剂为2,4-二硝基氟苯(DNFB),在妥布霉素结构中引入有紫外吸收的二硝基苯基基团,使妥布霉素及其杂质具有紫外吸收,进而采用HPLC-UV的方法对其有关物质进行检查。 将进口注册标准JX20100135流动相条件由等度改成梯度洗脱,将经高分辨液质确认的4个杂质制订入标准。 新建立的有关物质检查方法能够将各个杂质与主峰进行有效分离,同时排除辅料和抑菌剂对杂质的干扰,特定杂质的检出由JX20100135的两个(新霉胺、卡那霉素B)增加到4个(脱氧链霉胺卡那胺、尼泊拉胺、新霉胺、卡那霉素B)(图1)。 采用Gastrolplus公司ADMET predictor 9.0软件对上述4个杂质进行毒性预测。 各杂质对大鼠和小鼠均有致癌性,其中脱氧链霉胺卡那胺和新霉胺还具有肝毒性。 3.5 抑菌剂的眼刺激性 采用3D角膜上皮模型评价抑菌剂眼刺激性,与传统的兔眼刺激法相比,该评价体系数据客观、灵敏度高,能够避免动物间的差异以及由动物外推至人的种属差异性。 应用该模型评价妥布霉素滴眼液中抑菌剂的眼刺激性,通过抑菌剂ET50的比较(ET50越小,眼刺激性越大),以孵育时间为横坐标,组织活性值作为纵坐标作受试物溶液对组织活性影响作折线图(图2)。 结果显示羟苯乙酯、羟苯丙酯各处方浓度用量24h均未测到眼刺激性,硫柳汞钠、苯扎氯铵、苯扎溴铵各处方浓度用量均表现出眼刺激性。 具有刺激性的硫柳汞钠、苯扎氯铵、苯扎溴铵在同一浓度(0.1mg/mL)下,刺激性程度依次为硫柳汞钠>苯扎氯铵(n- C12H25、n-C14H29取代)〉苯扎氯铵(n- C12H25取代)>苯扎溴铵(图3)。 本次评价还发现n-C12H25、n-C14H29取代的苯扎氯铵刺激性大于n-C12H25取代的苯扎氯铵。 在抑菌效力考察中,n-C12H25、n-C14H29取代的苯扎氯铵及n-C12H25取代的苯扎氯铵在同等的处方用量的情况下(0.1mg/mL),对真菌和细菌的抑菌效力均能达到A级(表4)。 建议滴眼剂中的苯扎氯铵使用刺激性较小的n-C12H25单体型苯扎氯铵。 3.6 抑菌效力的考察 妥布霉素滴眼液为抗生素类滴眼液,尽管抗生素有一定的抗菌作用,但是不同种类抗生素的抗菌谱不同,对抗菌谱以外的微生物起不到抑菌作用,因此多剂量眼用制剂应选择适当的抑菌剂,保证其在多次使用时不被微生物污染。 本次评价对21家企业的妥布霉素滴眼液进行抑菌效力研究,其中3家企业的产品未达到中国药典2015年版眼用制剂抑菌效力判断标准。 按照各企业抑菌剂使用情况,抑菌效力测定结果见表4。 对各个厂家产品抑菌效力进行分析,排除处方中除抑菌剂以外其他辅料的干扰。 由于妥布霉素属氨基糖苷类抗生素,对细菌的抑制作用较强,未添加抑菌剂和使用羟苯乙酯(处方浓度0.1mg/mL)的妥布霉素滴眼液对真菌的抑菌效力较差,未达到中国药典2015年版眼用制剂抑菌效力的要求。 苯扎溴铵抑菌效力较好,处方浓度为0.05、0.1和0.2mg/mL时抑菌效力均能达到A级,根据中国药典2015四部抑菌效力中抑菌剂使用应是最低有效浓度的原则,部分企业使用的苯扎溴铵的浓度未使用最低有效浓度,存在过量添加的问题。 4 结论 本次评价性抽验结果显示,国产妥布霉素滴眼液总体质量一般,产品合格率为99.4%。 不合格项目为抑菌剂羟苯乙酯的检查。 探索性研究揭示,目前国产妥布霉素滴眼液质量标准仍有提高的空间,有关物质、含量测定方法可做进一步修订。 该品种不同企业抑菌剂添加的情况也不同,建议加强对抑菌剂处方筛选的研究。 抑菌剂对眼部均有不同程度的刺激性,过量使用抑菌剂,将会给临床用药带来安全隐患。 同时眼用制剂中某些抑菌剂由于自身稳定性的原因,抑菌剂的浓度会随时间而逐渐降低,达不到有效浓度,不能保证药品使用的安全。 因此,抑菌剂的合理使用和质量控制是保证多剂量包装眼用制剂安全性、有效性的关键。 |