研究揭示脑体联系是“双车道”
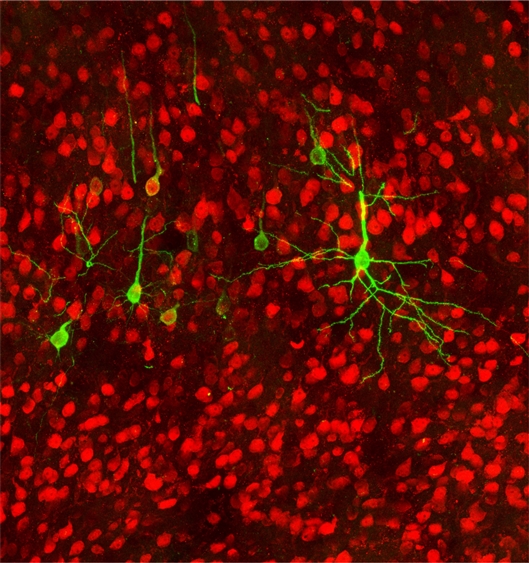
大鼠脑岛的神经元向下投射到胃里。图片来源:Strick和Levinthal
肠子不仅知道你吃了什么、“偷吃”你治病的药,还可能藏着早期大肠癌的线索,甚至让你得上自闭症。
这一切的背后推手正是肠道细菌。科学家已经知道,人体肠道中的细菌总数庞大,可以分解营养物质、训练免疫系统、阻止有害菌生长,以及造成疾病。而且,这些疾病并不局限于肠道。
近日,科学家在神经退行性疾病肌萎缩性脊髓侧索硬化症(ALS)小鼠模型中发现了一种新的肠—脑联系,为只有携带突变基因的部分个体会患上ALS提供了一种可能的解释。相关论文5月13日发表于《自然》。
但是,肠—脑联系并非单行道,大脑同样也会“主动出击”。5月18日,刊登于美国《国家科学院院刊》的一项研究,追踪了连接大脑和胃的神经通路,为了解大脑对器官功能的影响奠定了科学基础,并强调了脑—体轴的重要性。
肠子藏着“小锋芒”
每个人的肠道内平均约有40万亿个细菌,肠内菌群与各种疾病存在着关联。
结肠癌通常被认为是由随机基因突变引起的,但研究人员认为一种大肠杆菌可能是引发突变的“嫌犯”,它能产生破坏人类DNA的物质。研究团队将pks+大肠杆菌注射到人类肠道(在体外培养的类器官)细胞中。他们发现,这种微生物触发了不同的DNA损伤模式,证明这些细菌确实是引发结肠癌的原因。
除了肠道疾病,人们已经知道,肠—脑联系与一系列神经系统疾病有关,包括帕金森病和阿尔茨海默氏症。例如,肠道感染可以导致小鼠模型出现一种类似帕金森病的病理现象。
为弄清错误折叠的阿尔法—突触核蛋白能否从肠道扩散至大脑,研究人员向数十只健康小鼠肠道内注入25毫克折叠错误的人造阿尔法—突触核蛋白,然后隔一段时间对小鼠脑组织进行取样分析。
结果发现,问题蛋白质先是堆积在肠道与迷走神经的连接处,然后经迷走神经扩散至整个大脑。7个月后,阿尔法—突触核蛋白蔓延到其他大脑区域,包括海马、纹状体和嗅球。小鼠出现了抑郁和焦虑迹象、嗅觉功能障碍,空间学习和记忆与认知能力等也出现了障碍。
该研究通讯作者之一、加拿大蒙特利尔大学的Michel Desjardins告诉《中国科学报》,“在我们的病理生理学模型中,肠道感染是帕金森病的触发事件。这突出了肠脑轴在该疾病中的作用。”
此外,研究人员已经证实,果蝇若缺失KDM5家族蛋白,会影响肠道菌群平衡,进而出现类似自闭的症状。
除了导致疾病,肠道似乎还能决定携带同样基因突变的个体是否发病。
肌肉“僵” 肠子知
美国哈佛大学干细胞和再生生物学教授Kevin Eggan和团队,培养了一些转基因小鼠。起初,他们希望利用这些小鼠模型研究ALS的基因突变。结果,这些小鼠的免疫反应过于活跃,包括神经系统和身体其他部位出现炎症,导致寿命缩短。
但是,在其合作者位于博德研究所的实验室设施中开发的小鼠模型,却出现了不同的结果。尽管这些啮齿动物有相同的基因突变,它们的健康结果却截然不同。
“我们在哈佛小鼠身上观察到许多炎症特征,但在博德小鼠身上并不存在。更引人注目的是,博德小鼠活到了老年。”Eggan实验室的博士后、该论文主要作者Aaron Burberry说。
为了寻找小鼠差异的原因,研究人员对其肠道微生物进行了研究。通过DNA测序,研究人员发现了特定的微生物,它们存在于哈佛小鼠体内,而在博德小鼠中却不存在。研究人员又联系了其他使用该模型鼠的实验室,也观察到了不同结果。不同实验室的小鼠模型遵循的是标准化的实验程序。
于是,他们从不同的实验室收集了小鼠肠道微生物样本,并对它们进行了测序。结果显示,即便在相隔数百英里的研究机构,相似的肠道微生物也与这些动物的疾病程度相关。
而通过用抗生素或将博德小鼠的粪便移植给哈佛小鼠,研究人员成功减少了炎症,并最终确认了这个重要的肠—脑新联系。研究人员表示,肠道微生物群可能会影响疾病的严重程度,即携带基因突变的个体是否会患上ALS、与之相关的额颞叶痴呆,或者根本没有任何症状。
到目前为止,内脏与大脑相互作用的研究主要集中在肠道及其微生物对大脑的影响上。但这并不是一条单行道,例如大脑也会影响胃的功能。
双向通行
记者从美国匹兹堡大学获悉,该校大脑研究所的神经科学家已经追踪了连接大脑和胃的神经通路,并提供了一种生物机制来解释压力如何促进溃疡的发展。
“巴甫洛夫在许多年前就证明了,中枢神经系统能利用环境信号和过去经验产生预期反应,从而促进有效的消化。”该论文通讯作者、神经生物学家Peter Strick说,“我们早就知道,失业率等压力的每一次增加,都伴随着胃溃疡死亡率的增加。”
为了找到控制肠道的大脑区域,Strick和胃肠病学家David Levinthal,使用一种狂犬病病毒追踪从大脑到胃的连接。在被注入大鼠的胃后,病毒示踪剂回到大脑后从一个神经元传到另一个神经元,揭示了控制胃的大脑区域。狂犬病病毒使用相同的技巧通过咬伤或抓伤进入大脑。
研究人员发现副交感神经(休息和消化)系统的路径主要从胃追溯到大脑的侧岛叶,负责内脏感觉和情绪调节。“我们发现,胃将感觉信息发送到大脑皮层,皮层再将指令发送回肠道。”Strick告诉《中国科学报》,“这意味着我们的感觉不仅来自于胃发出的信号,还来自于其他对脑岛的影响,比如过去的经历等。”
相比之下,当人们感到压力时就会启动的交感神经(战斗或逃跑)系统的通路,主要从胃部回到初级运动皮层。
研究人员认为,识别这些连接大脑和胃的神经通路可以为常见的肠道疾病提供新的见解。例如,幽门螺杆菌感染通常会引发溃疡,但从大脑皮层传来的信号可能会通过调节胃分泌影响细菌的生长,从而使胃对入侵者更友好或更不友好。
这些见解也可能改变临床胃肠病学的实践,帮助医生们找到解决肠道问题的新方法。
“一些常见的肠道疾病,如消化不良或肠易激综合征,在目前的治疗下可能不会好转,而我们的研究结果提供了脑皮层靶点,这对开发新的基于大脑的疗法至关重要,可能对病人有帮助。”Levinthal说。

