2022年7月1日艾 力 斯(688578)投资者关系活动记录,GIC Pte Ltd、3W Fund Mgmt Ltd、Balyasny Asset Management、Goldman Sachs、Teng Yue Partners、Tiger Pacific Capital LP参与。
具体内容如下:
问:与其他三代EGFR-TKI相比,公司在商业化方面如何体现差异化?
答:公司商业化策略的差异化主要体现在几个方面。首先最重要的是源于我们产品的差异化。伏美替尼与其他EGFRTKI相比,具有差异化的竞争优势。第一,伏美替尼因其创新性药物结构,而带来药物特性的全面优化,是一个具有突破性的三代EGFRTKI。伏美替尼具备双活性,双入脑,高选择,代谢佳四大特性。正是基于其优秀的临床前及临床数据,先后被CDE授予EGFR敏感突变一线治疗和EGFR20外显子插入突变两个适应症的突破性治疗品种认证。第二,伏美替尼疗效卓越。一、针对二线治疗,伏美替尼是首个在治疗EGFRT790M突变NSCLC的注册临床研究中,ORR(客观缓解率)达到74%的三代EGFRTKI。二、针对一线治疗,伏美替尼是首个在单药一线治疗EGFR敏感突变NSCLC的III期临床研究中,PFS(无进展生存期)达到20.8个月、较一代EGFRTKI降低疾病进展或死亡风险达56%的三代EGFRTKI。三、伏美替尼针对脑转移患者疗效出色。IIb期研究显示,伏美替尼对中枢神经系统(CNS)病灶的疾病控制率高达100%。IIa期研究显示,伏美替尼160mg/d治疗中枢神经系统(CNS)病灶的CNS无进展生存期达到19.3个月。一线治疗III期研究显示,在具有CNS转移的患者中,伏美替尼CNSPFS为20.8个月,CNSDCR为100%。第三,伏美替尼的安全性优异。在剂量爬坡研究中,直到240mg,均没有发现剂量限制性毒性,未达到最大耐受剂量。二线治疗,在80mg/d剂量下,≥3级不良反应发生率仅为8%;各单项≥3级不良反应发生率不超过1.5%。一线III期临床研究,伏美替尼组在中位药物暴露时间(18.3个月)长于吉非替尼(11.2个月)的情况下,≥3级不良发应发生率(11%)低于吉非替尼(18%)。其次是我们推广策略的差异化。作为一家创新药企业,公司始终坚持专业的学术推广。基于伏美替尼“脑转强效、疗效优异、安全性佳、治疗窗宽”等临床优势,公司制定了差异化的学术推广策略。同时在市场准入方面,公司坚持医保&商保双渠道,惠及更多肺癌患者。伏美替尼二线适应症已于2021年进入国家医保,并被纳入40个城市的普惠型商业补充医疗保险。随着医保的落地执行,伏美替尼将抢占更多二线治疗市场。
问:目前伏美替尼一线治疗适应证的NDA申请进展情况?
答:伏美替尼一线治疗III期临床试验达到主要终点后,公司积极与CDE沟通,推进一线治疗适应证的NDA申报工作,并于2021年2月被CDE纳入突破性疗法品种,获得优先审评资格。截至目前(2022年6月21日)相关工作正处于顺利推进中。
问:三代EGFR-TKI市场竞争激烈,能否请公司展望下未来三代的竞争格局?公司将如何应对?
答:目前国内已有3个三代EGFR-TKI获批上市,未来2-3年内,预计将有其他三代EGFR-TKI陆续获批。面对这种格局,公司将做好产品的全生命周期管理,充分挖掘伏美替尼的临床优势,持续扩大伏美替尼的适应症,积极开展针对伏美替尼各项适应证的临床试验。伏美替尼二线治疗适应证已于2021年获批,并已进入国家医保;一线治疗适应证将于今年获批;此外,辅助治疗适应证目前处于III期临床试验阶段;针对20外显子插入突变适应证目前处于Ib期临床研究阶段,并即将开展II期临床试验。正如我们前面介绍的,因为伏美替尼结构优势所具备的剂量窗宽,安全性好等临床特性,使其具备了其他EGFR-TKI所不具备的更加广泛的获益人群。伏美替尼不但可以开发用于EGFRT790M突变,EGFR敏感突变NSCLC的晚期治疗和辅助治疗,还可以开发EGFR20ins等非典型突变的治疗、和其他治疗模式的联合治疗。更加广泛的获益人群,意味着更多潜在的市场份额占比。公司也将制定针对性、差异化的营销策略,逐渐树立伏美替尼在EGFR突变肺癌领域的地位,区隔新竞品。
问:20插入突变的市场潜力有多大?伏美替尼20插入适应证目前的进展情况如何?
答:肺癌是全球和中国发病率最高的癌症种类,其中非小细胞肺癌是最常见的肺癌类型,发病数量约占肺癌总数的85%左右。根据弗若斯特沙利文的分析,20号外显子插入突变类型占EGFR突变非小细胞肺癌患者比例约为10%左右,2019年中国EGFR/HER220号外显子插入突变非小细胞肺癌新发患者的数量为3.0万,预计到2024年将达到3.5万。而目前国内尚无针对20insNSCLC的药物获批上市,该领域存在一定未被满足的临床需求。伏美替尼治疗床宽,安全性良好,根据此前公司在2021年9月的欧洲肿瘤内科学会(ESMO)发布的伏美替尼用于EGFR20外显子插入突变非小细胞肺癌的Ib期临床研究数据显示,在10例应用伏美替尼240mg/d剂量的初治患者中,经独立影像评估委员会(IRC)评估的客观缓解率(ORR)达到60%,经研究者评估的ORR达70%,IRC和研究者评估的疾病控制率均为100%,中位无进展生存期尚未达到,且安全性良好,提示伏美替尼有潜力成为该类难治性患者的一种有效治疗方案。伏美替尼治疗EGFR20号外显子插入突变适应证已于2022年5月被CDE正式纳入突破性疗法品种,目前其正处于Ib期临床研究阶段,公司即将开展相关II期临床试验。
问:目前公司临床前研发管线的最新进展情况?
答:除了伏美替尼外,公司有5个在研产品均处于临床前阶段,包括KRASG12C抑制剂、KRASG12D抑制剂、RET抑制剂、SOS1抑制剂和第四代EGFR-TKI。目前,KRASG12C抑制剂、KRASG12D抑制剂已进入CMC阶段。
问:目前与江苏复星的合作进展情况?
答:公司与江苏复星在今年4月达成合作,江苏复星在肿瘤创新药领域具有广阔的渠道覆盖,目前已助力伏美替尼在广阔市场覆盖近150个城市、1,500余家医院。过去的一个多月,公司也协助江苏复星完成了产品培训,增进对方销售团队对伏美替尼产品特性的了解。接下来,公司也将继续协助江苏复星进一步提升伏美替尼在广阔市场的客户认知,加强市场渗透。
问:公司未来在BD方面是否有Lincense-in方面的布局?
答:公司秉持“核心产品+内部研发+合作引进”三驾马车并驾齐驱的发展策略,非常重视BD引进方面的拓展。公司在高度重视自身研发能力、确保内生增长活力的同时,将紧盯行业研发动态,加强与行业翘楚的交流,积极寻求对外合作的机会,将根据市场情况通过寻求投资、收购和控股相应研发公司或相关在研药品等多方式,切入其它药品研发领域。通过内生外延双轮驱动,丰富公司产品的治疗领域,保持公司不断创新的活力。
艾 力 斯主营业务:肿瘤小分子靶向创新药的研发
艾力斯2022一季报显示,公司主营收入1.11亿元,同比上升202.32%;归母净利润-2267.34万元,同比上升48.82%;扣非净利润-3725.87万元,同比上升40.49%;负债率3.35%,投资收益432.19万元,财务费用-282.68万元,毛利率95.39%。
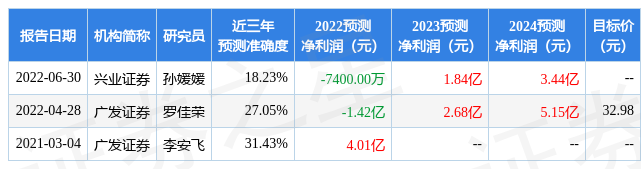
该股最近90天内共有3家机构给出评级,买入评级2家,增持评级1家;过去90天内机构目标均价为32.98。
以下是详细的盈利预测信息:
融资融券数据显示该股近3个月融资净流入2775.64万,融资余额增加;融券净流入3201.65万,融券余额增加。根据近五年财报数据,证券之星估值分析工具显示,艾力斯(688578)行业内竞争力的护城河一般,盈利能力较差,未来营收成长性较差。财务可能有隐忧,须重点关注的财务指标包括:应收账款/利润率、经营现金流/利润率。该股好公司指标0.5星,好价格指标1星,综合指标0.5星。(指标仅供参考,指标范围:0 ~ 5星,最高5星)

