免疫疗法为肿瘤患者带来了很大的希望,提示我们肿瘤治疗的重点应该是利用人体自身的免疫系统。
通过CAR T、抗PD-1的成功开发,我们逐渐了解到针对T细胞疗法的本质是依赖于其他细胞信号的传递,如先天免疫细胞。所以先天和适应性免疫反应在肿瘤治疗中的作用都不应该被小觑。
因此,想要在所有患者中根除肿瘤、取得免疫治疗的彻底成功,开发和有效利用先天免疫系统是达成这个目标的关键。
ILCs与肿瘤免疫
先天免疫细胞(ILCs)主要包括NK、ILC1/2/3这几类细胞,它们虽不能表达抗原特异性受体,但可以通过分泌多种细胞因子和蛋白调控免疫反应,介导肿瘤杀伤。(参考:先天样淋巴细胞功能及标志物)
但同时ILC也具有一定的促进肿瘤生长、进展的作用。本文中ILC主要指ILC1、ILC2、ILC3这三类细胞。
ILC1
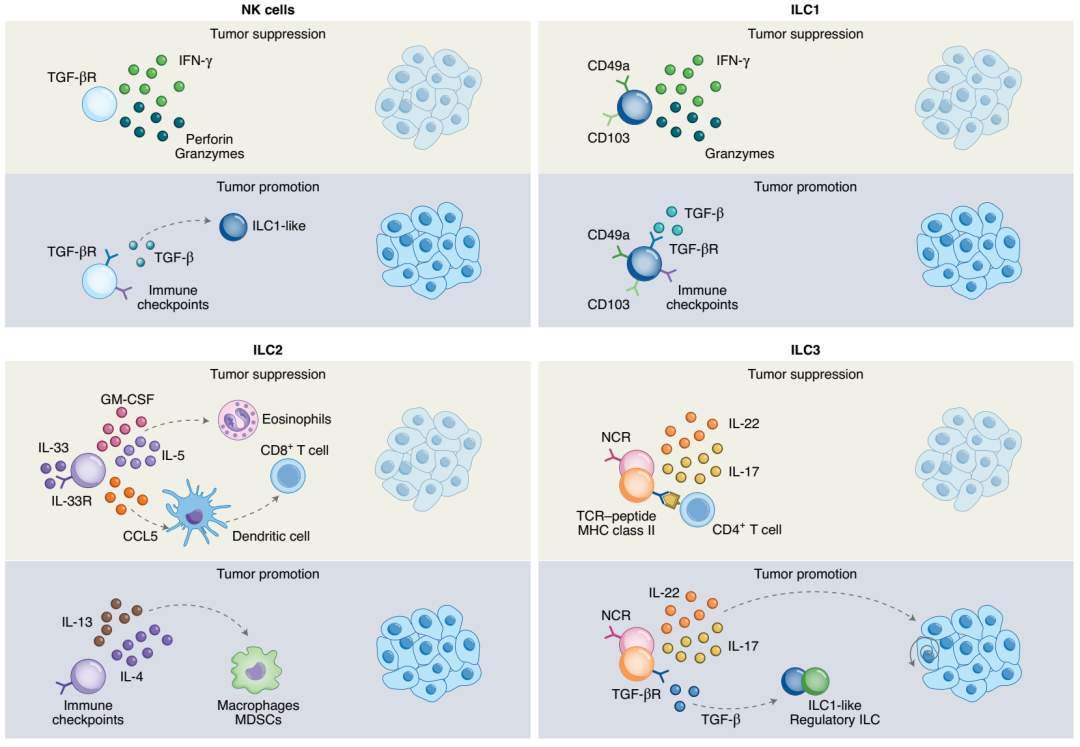
ILC1与NK拥有高度的相似性(参考:NK细胞标志物),表达T-bet、NKp46,还能够分泌IFNγ、颗粒酶介导肿瘤杀伤。但不同的是ILC1主要是控制肿瘤转移,而NK细胞则是限制肿瘤生长。
ILC1是早期ILC1(ILC1ls)在IL-15作用下成熟而形成的,而ILC1ls对肿瘤细胞杀伤能力差,免疫监视作用弱,甚至表现出促肿瘤效应。而且成熟的ILC1也会表达检查点受体,抗肿瘤功能会被TME中的TGF-β信号抑制。
ILC2
是ILC中最重要的细胞群,它的发育和维持依赖转录因子GATA3,通过分泌2型细胞因子介导肿瘤杀伤和影响肿瘤预后。在IL-33作用下,ILC2能够通过分泌GM-CSF、IL-5募集嗜酸性粒细胞,分泌CCL5募集CD8+T细胞,对先天和适应性免疫细胞进行活化,增强抗肿瘤功能。
ILC2也表达免疫检查点受体,在PD-1、IL-4、IL-13信号下,会募集巨噬细胞和髓源性抑制细胞(MDSC),促进肿瘤进展。
ILC3
依赖于RORγt编码,分泌IL-17、IL-22,根据TME成分发挥促瘤抗瘤双向作用。会在IL-12、IL-15诱导下分化为NK样细胞,获得细胞毒性。还会响应TGF-β信号最终分化为ILC性调节细胞(ILCreg),分泌IL-10,促进肿瘤生长。
Nat Immunol. 2022 Mar;23(3):371-379.
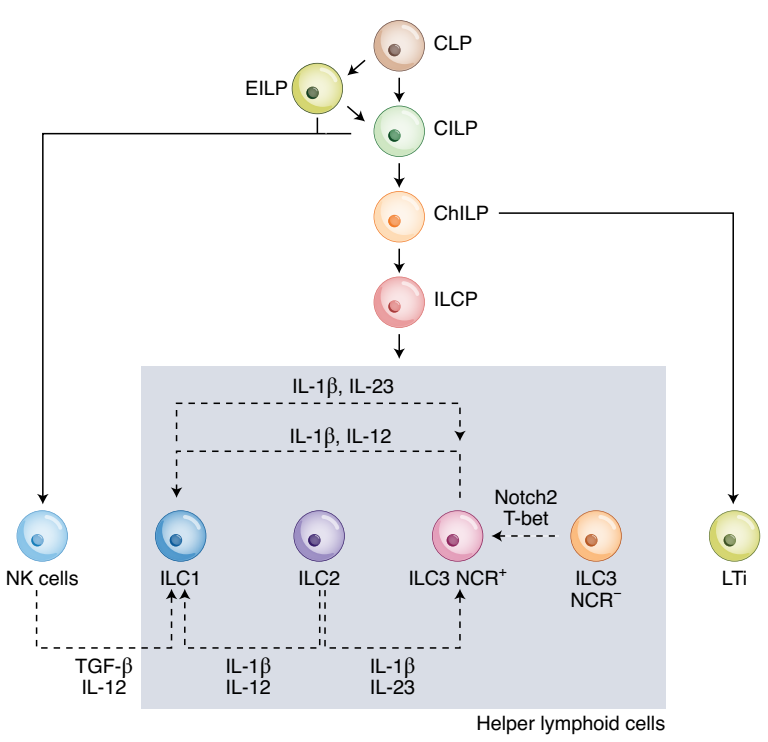
ILCs的迁移能力和可塑性
ILC虽然是组织驻留细胞,但也能够响应趋化因子信号而迁移到炎症部位以发挥其功能。相较于健康患者,肿瘤患者循环ILC升高,说明具有一定的迁移能力。而且在小鼠中已经证实CXCL13能够促进ILC向乳腺肿瘤迁移。
ILC还具有高度可塑性,迁移到TME后能够快速响应微环境中的信号,并被诱导分化为其他细胞表型。
TGF-β是调控ILC发育的主要信号分子,它能够诱导NK细胞分化为ILC1样细胞,并下调转录因子EOMEs的表达。而这类ILC1样细胞就失去了抑制肿瘤生长和转移的功能。
TGF-β还会促进ILC2表达IL-23,在IL-1β、IL-23诱导下进而分化为RORγt-ILC3,并能够分泌IL-17。
TGF-β还能够促进NCR-ILC3向NCR+ILC3分化,NCR+ILC3能够在IL-1β、IL-12诱导下基序分化为ILC-1,并能够分泌IFN-γ。
在鳞癌患者中观察到IL-1β、IL-23信号能够诱导ILC1转化为ILC3样细胞。
IL-1β、IL-12能够诱导ILC2分化为ILC1,使STAT3信号减弱、IL-5分泌减少、IFN-γ分泌增加、T-bet表达增加。(COPD和CROHN中)
Nat Immunol. 2022 Mar;23(3):371-379.
ILCs各细胞型可塑性存在差异,几乎所有的ILCs在TME中都具有向ILC1分化的潜力,但其他类型ILCs向ILC2分化的情况仍未被观察到。因此通过对多种趋化因子的精细调控是肿瘤治疗中的一个关键方向。
ILCs与肿瘤治疗
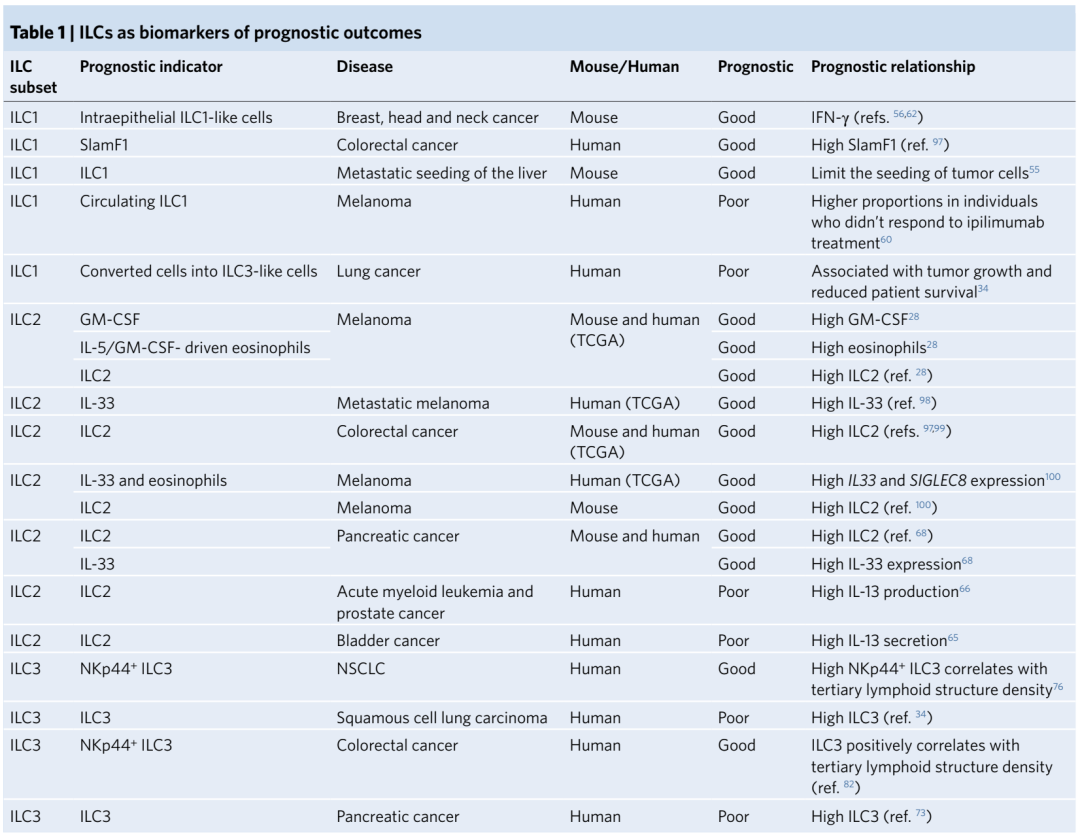
过继NK疗法在肿瘤治疗中已经获得了很好的结果,而基于ILCs的的细胞疗法还没有明显势头,但是其标志物的表达与肿瘤患者的生存结果相关性非常好。TME中精细定位的ILCs可以作为肿瘤治疗患者分层的预测性工具。
Nat Immunol. 2022 Mar;23(3):371-379.