考点一 理解溶解度曲线上点的含义以及溶解度随温度的变化趋势
直角坐标系中, 溶解度曲线上的点, 表示某温度下该物质的溶解度.看两条溶解度曲线交点所表示的意义时, 要注意指明温度.几条溶解度曲线的某交点, 表示某温度下某几种物质的溶解度相同、饱和溶液的溶质质量分数也相同.分析物质在不同温度下的溶解度随温度的变化趋势, 要看曲线的坡度及走向.
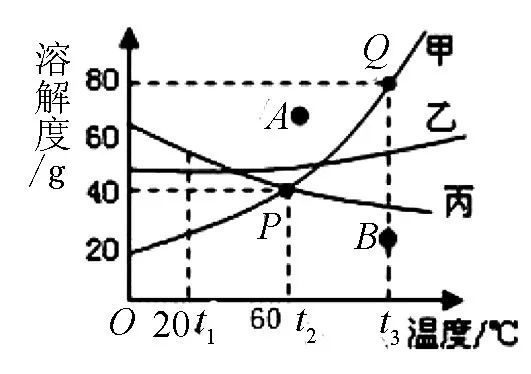
曲线划分面:曲线下面的点, 表示某温度下溶液为不饱和溶液 (如图1中B点) , 曲线上面的点, 表示某温度下的饱和溶液, 并且还要看有没有溶解完的固体 (通常称之为过饱和溶液, 例如图1中A点) .
例1 图1是甲、乙、丙三种固体物质的溶解度曲线图, 请回答:
(1) 在20℃时甲、乙、丙的溶解度大小关系是____ ;
(2) 若甲中含有少量的乙杂质, 提纯甲的方法是____ 结晶.
解析: (1) 根据溶解度曲线可以比较不同温度下物质的溶解度的大小, 据图1可以看出, 在20℃时, 丙的溶解度大于乙的溶解度, 乙的溶解度大于甲的溶解度; (2) 甲的溶解度受温度影响变化明显, 若甲中含有少量的乙杂质, 可以采用降温结晶的方法提纯甲.
答案: (1) 丙>乙>甲; (2) 降温.
方法指导:三种曲线三个代表两种方法, 即甲曲线溶解度随温度升高而增大, 受温度影响大曲线较陡, 可代表硝酸钾, 该种采用降温结晶的方法 (或者冷却热的饱和溶液) 得到固体;乙曲线溶解度随温度升高溶解度增大, 受温度影响小曲线平缓, 可代表氯化钠, 采用蒸发结晶的方法得到固体;丙曲线溶解度随温度升高而减小, 可代表氢氧化钙.
考点二 区别饱和溶液与不饱和溶液及其相互转化
根据概念判断, 在某温度时, 向一定量溶剂里加入某种溶质, 当该溶质还能继续溶解时所得到的溶液叫做不饱和溶液, 当溶质不能继续溶解时所得到的溶液) 叫做饱和溶液.若×100g<溶解度, 则该溶液为不饱和溶液;若×100g=溶解度, 则该溶液恰好为饱和溶液;若×100g>解度, 该溶液也为饱和溶液, 且有未溶解的固体.一定条件下, 饱和溶液与不饱和溶液会相互转化.
对于大多数固体 (溶解度随温度升高而增大的物质) , 若将不饱和溶液降低温度、增加溶质或蒸发溶剂, 可转化成饱和溶液, 若将饱和溶液升高温度、增加溶剂, 可转化成不饱和溶液.
对于极少数固体 (溶解度随温度升高而减小的物质) , 则:
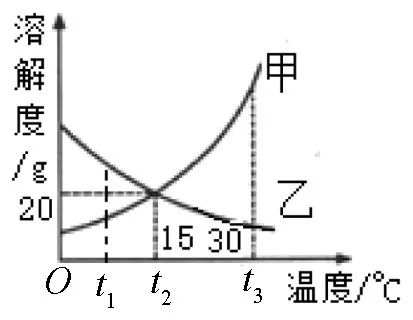
例2 图2为甲、乙两种固体物质在水中的溶解度曲线.下列说法正确的是 ( )
(A) 将乙的饱和溶液过滤, 能得到不饱和溶液
(B) 分别将t2℃的甲、乙两种物质的饱和溶液降温到t1℃时, 乙溶液还是饱和溶液
(C) 将t3℃时的乙饱和溶液降温至t2℃, 溶质的质量分数变大
(D) 将10%的甲溶液从30℃降温到15℃时, 没有晶体析出
答案: (D)
方法指导:要确定某一溶液是否饱和, 就要看在该温度下, 有没有不能继续溶解的剩余溶质存在.若没有固体剩余时, 应考虑可能恰好溶解达到饱和的情况.若有固体剩余时, 且溶质的量不再变化, 那么这种溶液就是饱和溶液.
考点三 溶液的溶质质量分数的计算与比较
首先要判断在某温度下的溶液是否为饱和溶液, 若溶液为不饱和溶液, 则用公式:溶质质量分数=×100%;若溶液为过饱和 (有未溶解完的固体) 或饱和溶液, 则用公式:溶质质量分数=×100%.通过计算可比较溶质质量分数的大小.
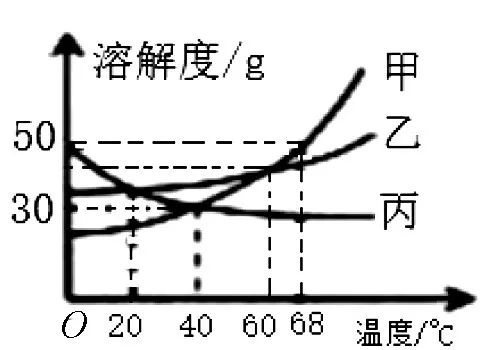
例3 图3为甲、乙、丙三种固体物质 (均不含结晶水) 的溶解度曲线, 下列说法正确的是 ( )
(A) 40℃时, 甲溶液与丙溶液中溶质的质量分数一定相等
(B) 将68℃时甲的一定量饱和溶液降温至40℃, 溶液质量变大
(C) 68℃时, 把100g甲物质放入100g水中, 充分搅拌后, 所得溶液的溶质质量分数为50%
(D) 68℃时, 分别在100g水中各加入31g甲、丙, 同时降温至40℃, 甲溶液、丙溶液均为饱和溶液
解析:没有说明甲、丙溶液是否饱和状态, 不能比较溶质的质量分数的大小;68℃时, 甲的一定量饱和溶液降温至40℃, 有晶体析出, 溶液的质量减少;68℃时, 甲的溶解度为50g, 故把100 g甲物质放入100g水中, 充分搅拌后, 所得溶液的质量为150 g, 溶液的溶质质量分数约为33.3%;40℃时, 甲、丙的溶解度均为30g, 68℃时, 分别在100 g水中各加入31g甲、丙, 同时降温至40℃, 甲、丙溶液均为饱和溶液, 且都有未溶解的固体存在.选项 (A) (B) (C) 错误, 选项 (D) 正确.
答案: (D)
方法指导:理解掌握饱和溶液和不饱和溶液的概念及其相互转变方法, 以及物质的溶解和结晶的方法等相关知识, 根据溶解度曲线图, 查找分析溶解度及其变化趋势, 运用公式计算出溶质质量分数, 逐项分析判断, 方可选择得出正确答案.
本文由初中化学大师原创,欢迎关注,一起涨知识!
允许非盈利性引用,并请注明出处:“转载自初中化学大师”字样,以尊重作者的劳动成果。版权归原作/译者所有。未经允许,对非法转载者,保留采用法律手段追究的权利