本篇文章正文共2643字
预计阅读时间约为8分钟
四十年前,麻省总医院的几位科学家在美国东北的鱼人码头解剖一条被他们称为“世界上最丑鱼类”的鱼,而纽约一家退伍军人医院的医生则在美国西南的荒漠捕捉毒蜥蜴。
四十年后,经过药厂持续研发和不断改进,他们看似毫不相关的研究成果却为减肥带来了革命性变革——2021年,美国食品药品管理局(FDA)批准司美格鲁肽用于肥胖(BMI≥30 kg/m2)或患有至少一种并发症(高血压、2型糖尿病或高胆固醇血症)超重(BMI≥27 kg/m2)成年人的长期体重管理。

图1. 琵琶鱼
图2. 吉拉毒蜥
在作为减肥药上市之前,司美格鲁肽首先被批准治疗2型糖尿病。它属于胰高血糖素样肽-1(GLP-1)受体激动剂药物,这类药物与天然GLP-1分子类似,可以通过激活GLP-1受体改善葡萄糖耐量,并适当降低体重。虽然GLP-1受体激动剂与减肥相关的作用机制尚不完全清楚,但其可以增加饱腹感,降低食欲。
这些科学家对琵琶鱼和吉拉毒蜥的关注,最初是因为这两种动物可以让他们方便地提取研究对象——消化道激素。
发现:始于琵琶鱼的胰岛
20世纪70年代,重组DNA技术问世,让准确快速解码蛋白质氨基酸序列成为可能。Joel Habener当时是麻省总医院一位年轻的内分泌学家,他致力于利用这些新技术鉴定编码胰高血糖素等多肽激素的基因。但哺乳动物的胰岛内分泌细胞分散在外分泌细胞之间,难以分离。因此,Habener把目光转向了琵琶鱼——一种外形丑陋,以尖利的牙齿和头部形似小灯笼的“拟饵”为特征的深海鱼类。琵琶鱼的胰岛几乎全由内分泌细胞组成,省去了复杂的纯化工作。
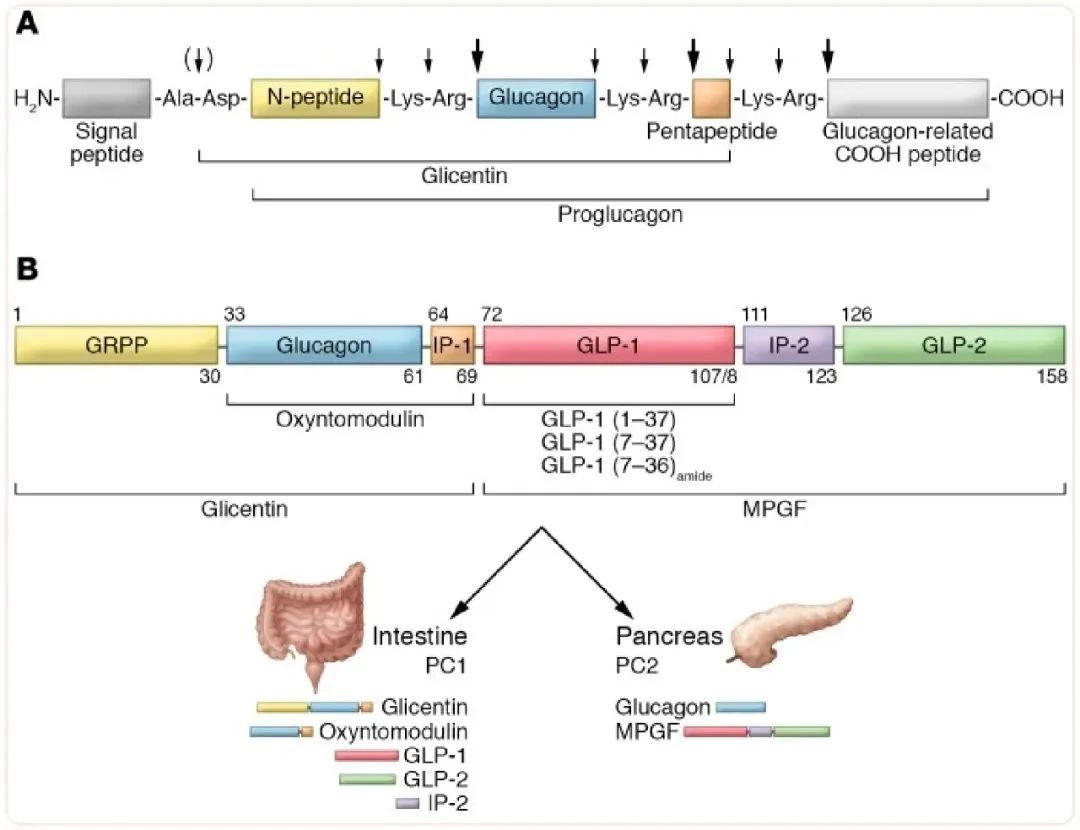
研究小组在波士顿居民的传统度假胜地科德角(Cape Cod)找到一位渔民,帮助他们在这片海域捕捞琵琶鱼。抓到鱼之后,Habener的博士后和博士生迅速取出胰岛并将其扔入液氮中冷冻。利用这些材料,Habener等人分离并鉴定出了琵琶鱼胰高血糖素原前体,发现琵琶鱼存在由两个不同非等位基因编码的胰高血糖素原——除了胰高血糖素,它们还各自包含一段胰高血糖素相关序列。此后,其他研究者陆续鉴定出仓鼠、牛和人类等哺乳动物胰高血糖素原序列;与琵琶鱼不同,哺乳动物的胰高血糖素原前体同时含有胰高血糖素和两种胰高血糖素相关肽,研究者将其命名为GLP-1和GLP-2(图1)。在不同物种中,GLP-1的序列高度保守,暗示其具有非常重要的生物学作用,这也激发了科学家深入研究的兴趣。
图3. 琵琶鱼(A)和人类(B)胰高血糖素原的结构[2]
随后的研究发现,GLP-1可以刺激胰岛素分泌,抑制胰高血糖素分泌,降低血糖。另外,GLP-1还显示出减慢胃肠动力、降低食欲和增加饱腹感的作用,这预示着它在治疗糖尿病和肥胖方面的潜力。然而,尽管静脉注射GLP-1可以使2型糖尿病患者空腹血糖恢复到正常水平,皮下注射GLP-1却几乎无效,因为其在体内会被二肽基肽酶-4(DPP-4)迅速降解,半衰期仅为1.5~2分钟。也就是说,天然GLP-1分子成药的可能性很小。
突破:吉拉毒蜥的毒液
当Habener等人解剖琵琶鱼的时候,纽约一家退伍军人医院的胃肠病科医生Jean-Pierre Raufman 正在探索昆虫和动物的毒液对哺乳动物胃肠道的刺激作用。Raufman曾在美国国立卫生研究院接受过科研培训,他发现吉拉毒蜥(Gila Monster)的毒液中含有某种生物活性分子,可以诱导实验动物发生胰腺炎。他的研究引起了同在退伍军人医院系统工作的多肽鉴定专家John Eng的兴趣,后者建议二人一起研究吉拉毒蜥。
吉拉毒蜥主要分布在美国西南部,是一种身长20英寸的有毒蜥蜴,有着橙黑相间的皮肤和短而有力的四肢。1992年,Eng从吉拉毒蜥的毒液中分离出一种氨基酸序列与GLP-1相似的多肽,他将其命名为exendin-4。Eng随后在糖尿病小鼠身上测试了这种肽,发现它不仅能降低血糖,而且效果能持续数小时。如果能在人类身上观察到同样的效果,那么这可能是将GLP-1类物质转变为糖尿病治疗药物的突破性进展。
成药:不断延长的半衰期
为了将exendin-4开发成药物,Eng希望他所在医院的上级管理部门退伍军人事务部能够申请专利,但该部门认为这项专利与退伍军人没有丝毫关系而拒绝了Eng的申请。退伍军人事务部的工作人员告诉Eng,他们对假肢一类的发明更感兴趣。最后,Eng在1995年自己申请了专利,并与Raufman一起四处推介,但是多数科学家并不买账,他们不相信蜥蜴上的发现能给人治病。直到1996年,在一次会议上,Eng的壁报展示引起了Amylin公司的注意,最终同意基于该专利开发药物。Amylin与礼来制药联合开发了艾塞那肽——exendin-4的人工合成版——这是第一个基于GLP-1的药物,每天注射两次,帮助患者治疗2型糖尿病。除了降低血糖外,艾塞那肽还显示了额外的好处,即让使用者体重减轻。
艾塞那肽的成功激发了其他制药公司开发更有效、更持久的GLP-1药物的热情,丹麦制药公司诺和诺德在这场竞争中走到了前列。通过巧妙的化学修饰,诺和诺德将GLP-1药物在体内的半衰期延长至13~15小时,推出了每天只需注射一次的利拉鲁肽,该药物先后经FDA批准用于2型糖尿病患者的血糖管理和减肥。
随后,对分子结构的进一步调整让更长效的司美格鲁肽被研发出来。司美格鲁肽是一种由30个氨基酸组成的多肽,与人类天然GLP-1分子具有94%的氨基酸序列同源性,半衰期长达165小时,每周只需注射1次。
进击:从糖尿病到体重控制
与先前上市的GLP-1药物一样,司美格鲁肽最初也被用作降糖药。2017年12月,司美格鲁肽注射液获批用于2型糖尿病患者的血糖控制,该批准基于SUSTAIN系列研究的结果。SUSTAIN研究探索了皮下注射司美格鲁肽用于2型糖尿病患者的安全性和有效性,发现与安慰剂和其他抗糖尿病药物,包括甘精胰岛素、艾塞那肽、利拉鲁肽等相比,司美格鲁肽在降低糖化血红蛋白(HA1c)和减轻受试者体重方面显示出明显的优越性。
两年后,基于PIONEER研究证据,FDA批准司美格鲁肽口服片剂用于改善成年2型糖尿病患者血糖控制,这也是首个不需要通过注射给药的GLP-1药物。
虽然在SUSTAIN和PIONEER中已经观察到司美格鲁肽的减重效果,但STEP系列研究提供了更确切的证据。STEP1研究是一项随机、双盲、安慰剂对照、全球多中心3期临床研究,招募BMI≥30 kg/m2或BMI≥27 kg/m2合并肥胖相关疾病(不包括糖尿病)的成人,比较每周皮下注射1次司美格鲁肽(2.4mg)或安慰剂并辅以生活方式干预对患者体重的影响,结果显示司马格鲁肽组从基线到68周时体重平均减轻14.9%,而安慰剂组仅减轻2.4%。STEP2招募了BMI≥27 kg/m2且合并2型糖尿病的患者,在这项试验中,司美格鲁肽组患者体重减轻幅度比安慰剂组患者大6.2个百分点(9.6% vs. 3.4%)。基于上述结果,司美格鲁肽注射液获FDA批准用于体重管理。
需要注意的是,司美格鲁肽并非适用于所有人。一方面,司美格鲁肽会引发不良反应,其中最常见的是恶心和呕吐,这可能会导致约8%的患者停药。另一方面,根据STEP4和其他研究的结果,停用司美格鲁肽后,人们仍然不得不面对体重反弹的事实,如果要维持减重成果,可能需要长期甚至终身用药。目前关于长期使用该药物的安全性尚不清楚,有证据显示或许会对甲状腺和胰腺产生不利影响。此外,高昂的费用恐怕也会让许多人望而却步。