快科技2月17日消息,大家知道,核辐射等高剂量辐射会击碎人体细胞内的DNA,一般是通过物理屏蔽、抗氧化剂进行防护,但却无法阻止辐射引发的正常组织程序性细胞死亡。
电离辐射造成的DNA损伤,会导致肠道细胞大规模凋亡,进而出现严重胃肠道综合症(GIS),导致肠黏膜脱落、出血甚至多器官衰竭,目前尚无特效药物。
近日,中国科学院广州生物医药与健康研究院首次证实,干扰素基因刺激因子(STING)蛋白可以通过一个全新的路径(PARP1-PAR-STING),直接决定细胞的生死。
研究人员通过系列实验,首次揭示了STING蛋白在DNA损伤修复中的全新作用机制。
研究发现,当细胞发生DNA损伤时,DNA损伤响应蛋白PARP1会合成一种名为PAR(多聚二磷酸腺苷核糖)的聚合物。
这种PAR聚合物能够直接与STING蛋白结合,形成“PAR-STING复合体”,从而放大DNA损伤信号,并启动细胞凋亡程序。
为了验证这一发现,研究人员进行了多项实验。
首先在细胞和小鼠实验中,使用特定剂量的PARP(聚腺苷二磷酸核糖聚合酶)抑制剂PJ34,减少80%的PAR生成,显著降低辐射后的细胞和小鼠死亡率。
随后,研究人员通过基因编辑技术构建了STING基因敲除的小鼠模型。
实验发现,这些小鼠在接受腹部辐射后,存活率提高了5倍,且肠道绒毛高度是正常小鼠的2.3倍。
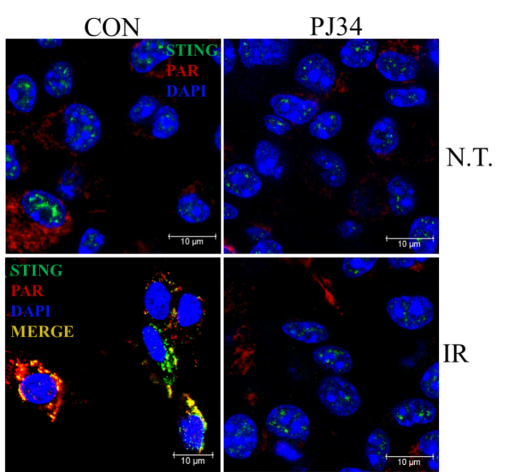
细胞实验揭示PAR-STING的“死亡纠缠”
这项研究改变了科学界对STING蛋白的传统认知。
过去认为,STING蛋白需要通过cGAMP分子来响应DNA损伤,但新研究发现,STING蛋白可以直接与DNA损伤时产生的高浓度PAR相互作用。
同时,研究通过多维度实验揭示了PARP1-PAR-STING信号通路在辐射诱导凋亡中的关键作用,为科学家理解STING蛋白在DNA损伤响应中的作用机制提供了全新视角,为辐射损伤防护和肿瘤治疗提供了重要理论依据和潜在干预靶点。
PARP1-PAR-STING介导的细胞凋亡模式图


