先天免疫细胞,如树突细胞(DCs),通过模式识别受体(PRRs)的病原体相关分子模式及损伤相关分子模式(PAMP/DAMPs),识别病原体及ICD等释放的癌症新生抗原等,以发现早期肿瘤。
这些机制触发促炎程序,释放促炎细胞因子、趋化因子和I型干扰素,并伴随DC细胞成熟和向淋巴结迁移,参与适应免疫系统,启动和激活抗原特异性T细胞。T细胞在趋化因子梯度的吸引下,浸润到肿瘤床,识别其同源抗原后,介导肿瘤消除。
肿瘤免疫循环(文献1)
其他先天免疫细胞,如巨噬细胞和自然杀伤细胞,分别通过吞噬作用和细胞毒性机制直接杀死肿瘤细胞来消除肿瘤。
天然免疫激活药物
Toll-like Receptors (TLRs)激动剂及拮抗剂
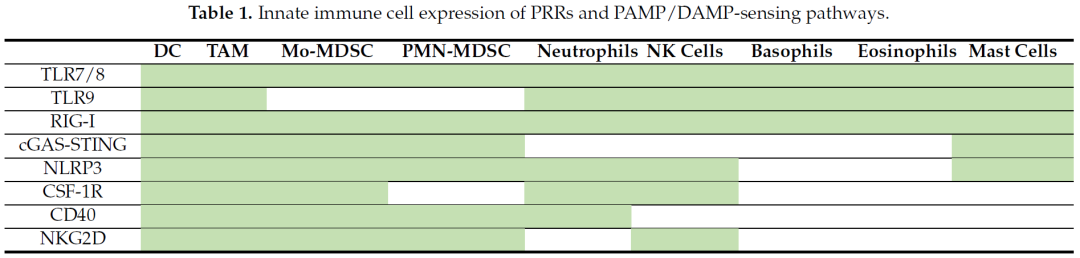
TLRs是在多种细胞类型中发现的高度保守的跨膜和细胞内PRRs,在先天免疫细胞监视微生物病原体中起着关键作用。
在人类中,已经鉴定了10个TLRs,它们表达于T细胞、B细胞、APC以及多种非免疫细胞,包括上皮细胞和内皮细胞。TLRs定位在细胞的两个不同区域:细胞膜和细胞内小体。TLR1、2、5和6存在于质膜,TLR3、7、8和9表达于细胞内小体,而TLR4两个位置都有。
TLRs肿瘤免疫双重作用
抗肿瘤活性
TLRs在肿瘤微环境表达于免疫细胞和肿瘤细胞。比如化疗等引起DMAPs,可以激活TLR4等导致DC成熟,激活TLR9激活pDC释放1型干扰素,激活TLR7/8诱导M2型TAM向抗肿瘤的M1型TAM极化。此外TLRs激活可以抑制Treg功能,增强CD8+T的存活,增殖和细胞因子产生。
促进肿瘤
NF-κB轴的激活上调抗凋亡因子(Bcl-XL、Bcl-2、生存素)
而且上调基质金属蛋白酶(MMPs),导致细胞外基质降解,TLR4的激活会导致MMP2和β1-整合素过度表达,TLR9的提高了乳腺癌中的MMP13。
TLR2、TLR4和TLR9诱导PG-E2和COX-2的增加,TLR4诱导EGFR磷酸化,是TLRs介导血管生成中最重要的机制。
激活TLR可刺激肿瘤细胞或肿瘤浸润细胞,产生抑制细胞因子和趋化因子,不仅抑制免疫细胞,而且吸引更多抑制性免疫细胞进入肿瘤微环境(如MDSC、TAM和CAF),以满足肿瘤的需求。
TLR下游信号可以使肿瘤细胞和肿瘤浸润细胞,将其代谢途径从氧化磷酸化转化为糖酵解。
三种TLR激动剂目前已获得FDA批准,并正在临床使用。
卡介苗是一种减毒的牛型结核分枝杆菌,是一种TLR2/4配体,被批准用于治疗浅表、非肌肉侵袭性膀胱癌。
TLR4激动剂monophosphoryl A被批准为疫苗佐剂
TLR7激动剂miquimod被批准用于治疗生殖器疣和基底细胞癌
一些临床阶段的TLRs激动剂
cGAS/STING
cGAS感受到胞浆病原体DNA或肿瘤细胞DNA,通过合成环状二核苷酸,cGAMP,激活STING(Stimulator of IFN genes),进而激活转录因子IRF-3 和 NF-kB,释放1型IFN。相关内容可以点击阅读: STING:天然免疫新核心,免疫治疗新靶点
合成环二核苷酸(CDNs)激活STING最成功,因为它们的结构通用性强,能结合STING等位基因变异体。
大多数STING是瘤内注射给药,但BMS-986301正在评估全身肌肉内给药。此外,GSK3745417是一种静脉注射激动剂,单独或与ICI联合治疗晚期实体瘤[NCT03956680,NCT03843359]
RLRs 和RIG-I
RLRs(Retinoic Acid Inducible Gene-I-like Receptors)识别病毒感染的产生的胞浆RNA,研究最多的是RIG1,MDA5,LGP2。RIG1介导了广泛的免疫刺激功能,包括DC成熟、T细胞启动、增强NK细胞脱粒和细胞溶解活性。RIG-I还通过内在和外在的凋亡途径,以及焦亡,启动细胞程序性死亡。
炎症小体
炎症小体(Inflammasome)是由感应器、适配器和酶原Proaspase-1组成的多聚蛋白复合物。
炎症小体的组装是天然免疫细胞对病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)的反应。
炎性小体通过引起Caspase-1自我剪切,活化,进而裂解Pro-IL-1β,Pro-IL-18,形成成熟IL-1β,IL-18.
活化的caspase-1也能裂解GasderminD,从而导致一种特殊的细胞死亡,称为细胞焦亡(pyroptosis)。
炎症小体相关内容可以点击阅读: 炎症小体(Inflammasome)及靶向药物
天然免疫细胞
DC细胞
DCs是天然免疫系统抗肿瘤反应的关键组成部分,针对DC细胞有多种策略:
针对PRRs的策略,如TLRs和RIG-I激动剂,通过激活DCs来介导其抗肿瘤作用。
DC细胞活化和动员剂,如FLT3配体,并正在临床试验中进行评估[NCT03789097]
对抗DC细胞的抑制程序,如使用STAT3和IDO抑制剂。
DC疫苗Sipuleucel-T已经上市。
TAM
将促进肿瘤发展的M2型TAM向抗肿瘤的M1极化,是主要策略。
Colony Stimulating Factor 1 (CSF-1)
阻断巨噬细胞CSF-1与CSF-1R结合,导致M2 TAM的缺失、M1 TAM富集,小鼠临床前模型肿瘤得到控制。CSF-1R的抗体和小分子抑制剂正在进行单药疗法临床研究,并与化疗和ICI联用。
PI3K-γ Inhibition
通过巨噬细胞内p110γ亚型激活PI3K,驱动向M2型TAM极化。抑制PI3Kγ可以促进巨噬细胞向M1 TAM极化,促炎症因子释放,起到抗肿瘤活性。IPI-549(Infinity Pharmaceuticals)正在进行临床研究。
CD47- SIRPa
CD47- SIRPa向巨噬细胞传递别吃我信号,阻断CD47- SIRPa成为热门的免疫开发策略。
更多内容可以点击阅读:CD47结构、功能、生物大分子药物开发
DC-SIGN
DC-SIGN,也被称为CD209,是免疫抑制TAMs的一种标记物。临床标本中的DC-SIGN+TAM浸润与免疫抑制调节性T细胞和耗尽的CD8T细胞(TIGITLAG3)比例的增加相关。针对DC-SIGN的单克隆抗体结合PD-1阻断治疗人肌肉侵袭性膀胱癌,与单药疗法相比,抗肿瘤活性增强,为临床发展奠定了基础。
其他的靶点还有精氨酸酶1,CCL5等。
巨噬细胞抗肿瘤开发靶点(文献1)
NK细胞
虽然在NK细胞上激活受体的治疗靶向已经很受关注,但大多数方法尚未进行临床试验。
NKG2D Ligands
研究最广泛的激活受体是NKG2D及其配体、主要的组织相容性复合物(MHC)I类链相关蛋白A(MICA)和MHCI类链相关蛋白B(MICB)。MICA和MICB是由细胞应激、损伤或转化诱导的多态蛋白,并通过结合细胞毒性淋巴细胞上表达的NKG2D受体充当“杀死我”信号。
不幸的是,许多癌症通过ADAM10、ADAM17和MMP14基质金属蛋白酶的蛋白水解裂解脱落MICA和MICB。金属蛋白酶的小分子抑制剂,蛋白酶体抑制剂等正在开发中。
NK Cell Engagers (NKCEs)
招募NK细胞的二抗,三抗等NKCEs在开发中。
NKG2A抑制剂
NKG2A是NK上的抑制性检查点,其抑制剂Monalizumab,在头颈部肿瘤的三期临床实验中有良好效果。
CAR-NK
CAR-NK细胞有做成现货型细胞治疗产品的潜力,正在收到全球的重视,一系列临床试验在开展中。相关内容可以阅读: NK细胞肿瘤免疫治疗
喵评:天然免疫细胞及分子通路,是机体抗肿瘤免疫的重要领域,本文对这个领域内的内容稍作梳理。
主要参考文献
Rameshbabu, S.; Labadie, B.W.; Argulian, A.; Patnaik, A. Targeting Innate Immunity in Cancer Therapy. Vaccines 2021, 9, 138. https://doi.org/10.3390/vaccines9020138
Ali Keshavarz et al,Toll-like receptors (TLRs) in cancer; with an extensive focus on TLR agonists and antagonists,IUBMB Life. 2020;1–16.
Yazdan Mokhtari et al,Toll-like receptors (TLRs): An old family of immune receptors with a new face in cancer pathogenesis,J Cell Mol Med. 2021;25:639–651.









