癌症治疗的最终目标是瞄准并杀死癌细胞,同时保留正常细胞。T细胞受体(TCR)为T细胞识别癌细胞突变提供了精确的靶向特异性。TCR不仅能识别外来异物,还能精准识别自身体内的癌症抗原,即便癌细胞表面只发生了细微的突变,也能被其捕捉识别。从人体内分离出可特异性识别肿瘤抗原的T细胞,获取其TCR基因序列,再将该基因序列利用载体引入T细胞中,让T细胞可以精准地杀伤癌细胞。以往的人类T细胞治疗依赖于重组病毒载体的使用,但以这种方式为每个接受治疗的患者生成多个个性化的临床级别载体是不现实的。
近日,美国加州大学洛杉矶分校(UCLA)研究团队联合生物技术公司PACT Pharma团队开发了一种基于CRISPR/Cas9非病毒精准基因编辑的临床级方法,可同时敲除两个内源性TCR基因:TRAC和TRBC,并插入TRAC定位的新抗原特异性TCR (neoTCR) 的两条链。 该研究成功改造了免疫细胞,使其能特异性识别每个患者的癌细胞,并发动集中攻击。 这是个体化基因编辑和癌症细胞疗法的首次整合,有望给癌症治疗带来深远影响。 该 研究结果发表 Nature 上,文章题为 “Non-viral precision T cell receptor replacement for personalized cell therapy” 。

PACT Pharma是癌症免疫学和细胞治疗领域的领导者,致力于开发个体化的NeoTCR-T细胞疗法,基于自体T细胞进行肿瘤特异性靶向治疗。此次,PACTPharma与UCLA团队合 作找到了能够精准识别癌细胞 的TCR,并将其基因序列通过CRISPR基因编辑,采用非病毒性载体进行递送,插入到T细胞中。
为了评估这一疗法的安全性和可行性, 在细胞剂量递增的首次人体1临床试验(NCT03970382)中,对16名难治性实体瘤患者(包括结肠癌、乳腺癌和肺癌)进行了多达三种不同的neoTCR转基因细胞产品治疗,每种产品均表达患者特异性n eoTCR。 研究团队从患者的血液中分离出免疫细胞,捕获了免疫系统34种HLA亚型的5000多个突变。 对免疫细胞特异性识别癌症突变的免疫受体进行基因测序,共分离175个新癌症特异性免疫受体(图1)。 然后,通过一步式CRISPR编辑,免疫受体被插入到患者自身的免疫细胞中,包括敲除现有的免疫细胞受体和敲入可重定向这些细胞以专门识别癌症突变的免疫受体。
图1.通过细胞标志物发现TCR的原理图。
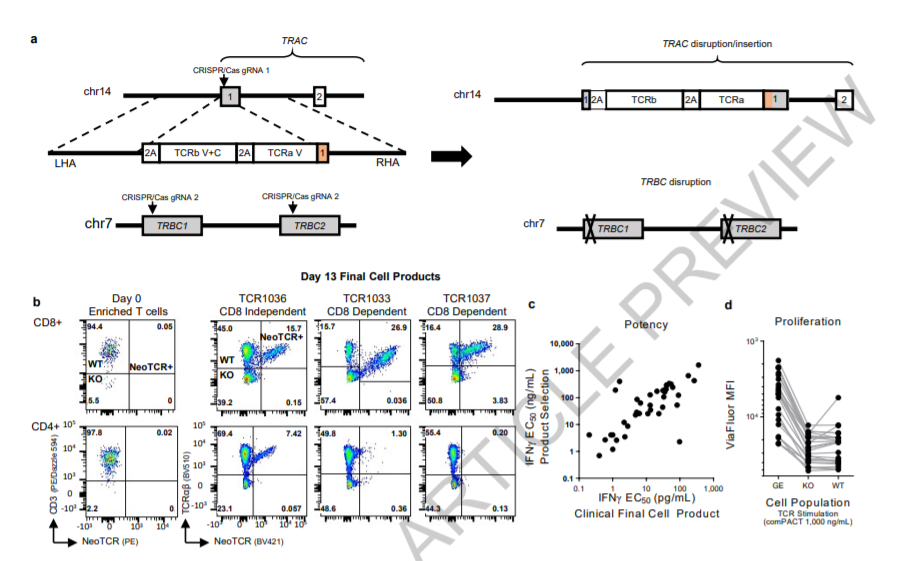
近期,一种类似的方法被用于将CD19嵌合抗原受体(CAR)插入PD-1位点,并注入具有高抗肿瘤活性水平的B细胞非霍奇金淋巴瘤患者。使用这种策略,研究团队克服了生成基于病毒载体的多种障碍(图2), 为患者量身打造个体化的TCR-T细胞疗法。 HR模板质粒的克隆和GMP标志物既快速又经济,与病毒载体的随机整合相比,T细胞基因组中的精确靶向整合提供了额外的安全级别;另一个优势是能够整合超过腺相关病毒和其他病毒载体包装限制的有效载荷。
图2.用于临床级细胞制造的非病毒精确基因组工程。
研究团队比较了临床试验中使用的新TCR活性与先前特征良好的TCR活性,发现新TCR活性较高。在最初的条件性化疗和两个低细胞剂量队列中,注入的新TCR基因编辑T细胞在体内的扩增非常有限,这可能导致临床获益的可能性很低。剂量递增研究从可能低于潜在临床反应所需的细胞剂量开始。在实体瘤环境中,TCR转基因T细胞临床试验显示(图3),临床活性在每个TCR范围内为5-10×10 9 ,在每个TCR超过100亿个细胞时没有明确的剂量反应。 试验过程中制造工艺的改进和细胞剂量的不断增加使最后给药患者的体内扩增更好,接近于其他研究中具有治疗作用的水平。
图3.临床试验患者及样本,血液中新OTCR转基因T细胞分析。
最后,个性化的neoTCR分离、克隆、验证和选择是一个漫长的过程,严重依赖于可供分析的肿瘤和PBMC样本的质量。对于TCR和新抗原变异性问题以及漫长的产品选择过程,一个潜在的解决方案是使用相同的TCR发现和验证技术,生成一个预先建立的针对常见突变和病毒抗原的TCR文库,涵盖多种HLA特异性。
研究团队展示了使用基于CRISPR的非病毒敲除和敲入编辑的能力,以基因重定向T细胞到突变的新抗原。该研究建立在基因组编辑和转基因TCR工程重定向T细胞特异性开创性研究的基础上,为实体瘤患者产生广泛适用、肿瘤特异性的个性化T细胞治疗。内源性TCR与neoTCR的替代导致T细胞只对特定HLA的突变产生反应,为T细胞工程和重定向到癌细胞提供了一个安全靶点。
《自然》发表评论表示,TCR-T细胞疗法的一大亮点在于治疗实体肿瘤,并通过初步临床试验进行了概念验证。此前,通过基因改造免疫细胞治疗癌症更多的是针对血液癌症,例如CAR-T疗法。实体肿瘤由于存在物理障碍,T细胞难以进入,此外在血液癌症中缺乏更“通用”的癌细胞抗原,仍需个体化设计。同时,肿瘤微环境也会抑制免疫细胞的功能。
虽然该新疗法的最初效力看起来并不强,但这只是一项初步尝试。研究人员们使用的T细胞剂量相对较低,如果在确定安全性后提高T细胞剂量,有望带来更好的效果。论文通讯作者AntoniRibas博士表示:“这是开发癌症个体化治疗的一个飞跃。作为该创新性细胞疗法的首个人体临床试验。该研究证实了个体化TCR-T细胞疗法的可行性和安全性,为癌症治疗开辟了新路径。期望它将会在未来的肿瘤治疗中大展身手,为患者带来新的希望!”