TCE双抗近两年在血液瘤领域取得突破,罗氏的CD20XCD3(Mosunetuzumab/Lunsumio®),杨森的BCMAXCD3(teclistamab-cqyv/TECVAYLI)先后获批上市,辉瑞的BCMAXCD3(双抗也已在美国和欧洲递交上市申请,并获得优先审评。TCE双抗的疗效由CD3抗体臂接合并激活的T细胞来决定,因而表征起作用的T细胞亚群,是研究TCE双抗疗效和耐药性的关键。
单细胞技术表征TCE效应亚群
治疗前和治疗中,对活检样本使用单细胞技术进行表征(细胞类型、基因表达、克隆性、功能特征等),是常用的方案。
需要注意的是,免疫细胞具有可塑性,受到肿瘤负荷、疾病分期、治疗的影响。个体患者的骨髓生态位在细胞组成和控制肿瘤生长的能力方面是异质的。这些因素使得识别、监测、表征免疫微环境具有相当的难度和不确定性。
TCE双抗通过CD3抗体臂接合T细胞,因而需要表征各类CD3+CD4+(包括Treg、初始、静止、记忆等亚群)、CD3+CD8+T细胞(初始、效应、记忆、耗竭、增殖等亚群)。
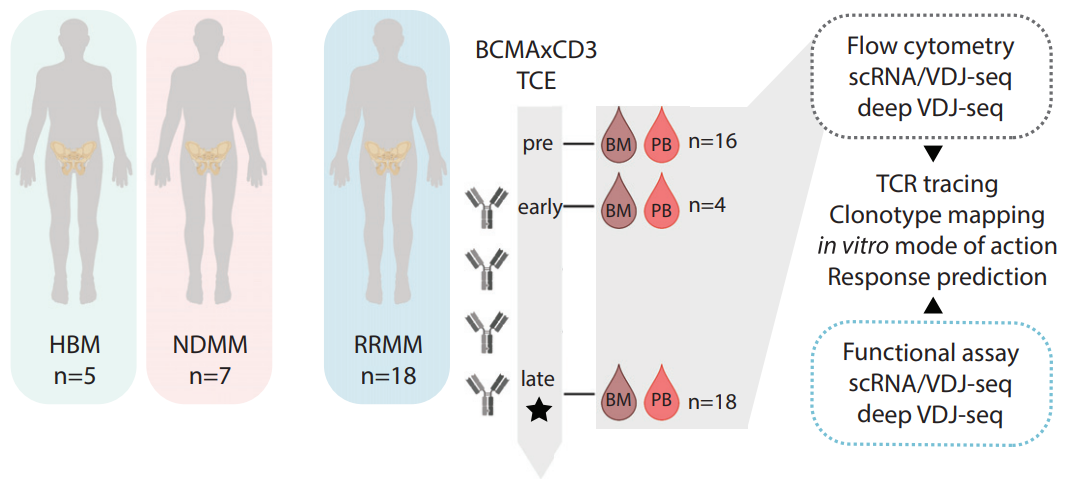
病人样本及技术方法(PF-06863135,NCT03269136)
细胞类型变化
TCE(BCMAXCD3,PF-06863135)治疗之后,分析各类CD3+T细胞亚群
CD4+记忆亚群比例降低
CD8+效应亚群增加
克隆性
对TCE双抗治疗有反应的患者,CD3+T细胞总体克隆扩增能力增强。
进一步追踪每一个克隆,发现大多数的克隆是稳定的,只有部分克隆扩增或者收缩。
扩增最为显著的是CD8+效应T细胞克隆,与细胞组成变化一致。
TCE双抗的抗肿瘤效应:来自于患者预先存在的CD8+效应T细胞
无应答的患者,预先存在的CD8+T细胞多为耗竭表型,应答患者则多为效应表型。
初始CD8+T细胞的克隆扩增是MHC-I分子依赖性的(可被MHC-I分子抗体阻断)。
MHC-I分子阻断,影响的是初始CD8+T细胞的活化和克隆扩增(加入MHC-I抗体,不能检测到Naive CD8+T细胞克隆)。
小结
双特异性TCE治疗多发性骨髓瘤的两种作用模式:预先存在的CD8+T细胞克隆优先扩增,初始CD8+T细胞的启动和及分化需要MHC-I分子。
MHC-1分子丢失是TCE治疗时肿瘤免疫逃逸的潜在机制之一。