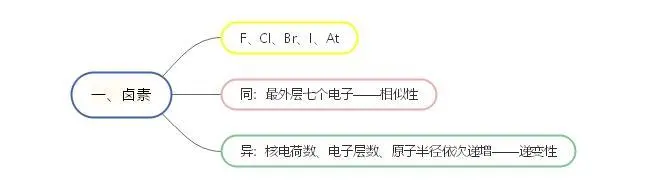
说起卤族元素,相信高考的各位学子都不会陌生。卤族元素即第七族VIIA族,包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。希腊原文halogen,意为“成盐元素”,这些元素都是典型的非金属元素,它们能与典型金属或碱金属化合成盐而得名,在自然界当中都以典型的盐类存在。卤族元素是高考的一大高频考点,本文将通过七个部分结合MindMaster制作的思维导图对其做详细介绍。
一、卤族元素之间的异同点
卤素中的各个元素位于同一族,因此最外层电子都为七个,周期递增,核电荷数、电子层数、原子半径依次递增。
二、单质
卤素的单质都是双原子分子,颜色随着分子量的增大而加深,熔点、沸点、密度、原子体积也依次递增。卤素最外层都是七个电子,因此都具有氧化性,从F到I原子半径依次增大,原子核对最外层电子的吸引力依次减弱,从外界获得电子的能力就依次减弱,单质的氧化性就依次减弱。下图为卤素单质的物理性质和化学性质:
三、Cl2 、HCl以及HClO
Cl2
Cl2常温常压下为黄绿色气体,剧毒,有强烈刺激性气味,不稳定具有强氧化性。氯气支持燃烧,除碳单质等少数物质以外许多物质都可在氯气中燃烧,可与金属进行燃烧反应生成盐,也可与氢气发生光照或燃烧反应生成盐酸,与磷进行反应氯气的量大量小会产生不同的化合物。氯气在工业上用途广泛,可用作制盐酸,制氯化铁,制漂粉精,自来水杀菌消毒。卤素单质的化学性质都不稳定,自然界中都以典型盐类存在,想要制得氯的单质,工业上最常见的方法是从饱和食盐水中提取,实验室制法通过浓HCl,MnO2固体进行加热提取。
HCl
盐酸(HCl)无色,刺激性气味气体,密度大于空气,极易溶于水,易挥发。可与氨气发生反应制得氯化铵,工业上通过氯气和氢气反应制得,实验室通过氯化钠和浓硫酸加热制得。
HClO
次氯酸(HClO)是一种弱酸,具有强氧化性,可用作消毒剂和漂白剂,化学性质不稳定,在光照条件下就会被分解,因此必须避光保存。
四、HX
卤素的氢化物均为无色有刺激性气味的气体,均易溶于水,易挥发。熔沸点由分子间作用力决定,分子量越大,分子间作用力越大,熔沸点越高,但HF中含有氢键,所以熔沸点最高。酸性指酸分子解离的能力,卤族元素从上到下原子半径依次增大,电负性依次减小,所以与H原子之间的吸引力越来越弱,H更容易电离出去,因此酸性由上到下依次增强。从上到下原子半径依次增大,原子核对核外电子吸引力依次减小,因此卤素所形成的的氢化物的稳定性依次减弱。
五、AgX
AgX具有水溶性和感光性,见光易分解,AgX都具有其特殊的用途,详见下图。
六、卤素提取
工业上卤素大多从海洋中提取,海水晒盐即可从海水中提取到卤素的各种氯化物,但含杂质量多,因此进行粗盐提纯。工业上常从海水中提取溴,海带中提取碘,具体流程如下图所示。
七、卤素离子检验
氯离子、溴离子、碘离子可通过沉淀法进行检验;溴离子、碘离子可通过置换萃取法进行检验;碘离子可通过氧化淀粉法进行检验。具体反应见下图。
思维导图在学习上是一个非常好的高效工具,大多数学科知识点都可通过思维导图进行整理。









