病毒载体在制造细胞疗法过程中扮演着重要的角色,以 CAR-T 细胞为例,需要利用病毒载体将表达 CAR 的基因片段插入到T细胞中。不过,病毒载体价格昂贵,对生产、制造以及供应都有较高的要求,一定程度上限制了细胞疗法的大量生产。
近日,加州大学旧金山分校(UCSF)的研究人员开发出了一种基于 CRISPR/Cas9 系统生产大量治疗性细胞疗法的新方法。这种新方法无需病毒载体即可帮助科学家高效将超长片段 DNA 序列(especially long DNA)精确插入细胞基因组中,而常规的方法都需要使用病毒载体将 DNA 递送到细胞中。

(来源:Nature Biotechnology)
具体来说,在研究中,研究团队将 Cas9 靶序列添加到单链 DNA 中,利用非病毒载体方式插入长 DNA 片段,并筛选一系列小分子化合物进一步促进同源定向修复,显著提高人类原代 T 细胞和其他造血细胞类型的非病毒敲入效率和产量。
团队指出,这种新方法为非病毒载体 CAR-T 细胞制造提供了一种良好的工艺流程,基因敲入效率达到 46% - 62%,一次操作可获得超10 亿个细胞(超 1.5 × 10^9)。这一产量已远高于治疗患者所需的细胞数量。
“多年来,我们的一大目标就是在不依赖病毒载体的前提下,将长片段的 DNA 序列精准插入基因组中的目标位点。我们现在提出的升级方法朝着开发出‘下一代’更安全有效的细胞疗法迈出了一大步。”本文的通讯作者 Alex Marson 博士说。
▲图|左为 Brian R. Shy 博士,右为 Alex Marson 博士(来源:cancerresearch)
Alex Marson 是格莱斯顿-加州大学旧金山分校(UCSF)基因组免疫学所主任,他实验室的研究方向是利用新型的 CRISPR 基因组工程技术理解调控免疫细胞功能的基因回路,尤其是 T 细胞。他与同事已经开发出了基于 CRISPR 可高效编辑人免疫细胞基因组的新工具,并将其应用于增强“下一代”细胞免疫疗法。
本文第一作者兼共同通讯作者 Brian R. Shy 博士是 Alex Marson 实验室的临床研究员,他的研究方向是基因组编辑工具的治疗应用,重点是基于非病毒载体 CRISPR/Cas9 方法的临床转化工作。
编辑效率提高超 1 倍,一次操作可生产超 10 亿个 CAR-T 细胞
多年来,Alex Marson 实验室的一个重点研究方向是专注于免疫细胞的功能基因组学,基于 CRISPR 基因组编辑方法筛选影响免疫细胞命运和功能的基因,并探索这些方法的应用潜力。
2015 年,Alex Marson 小组与 Jennifer Doudna 实验室合作,首次证明可以无需病毒载体将短 DNA 模板插入免疫细胞,即采用电穿孔的方式瞬时提高细胞膜的通透性,从而 DNA 引入免疫细胞中。
2018 年,研究团队开发了一种基于 CRISPR 将更长 DNA 序列片段剪切并粘贴到免疫细胞的方式;2019 年,他们发现了一种可与 Cas9 酶结合的改良版 DNA 模板,可更高效将 DNA 序列递送到目标基因组位点。
经过多年的积累,在最新的研究中,该团队进一步提升了基因编辑效率和生产重编程细胞的产量。
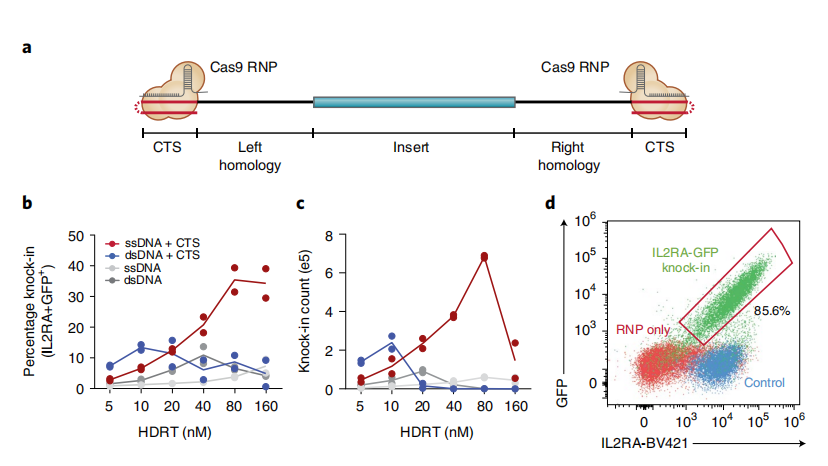
我们知道,DNA 以单链或双链形式存在,而 Cas9 附着在双链 DNA 上。高浓度双链 DNA (dsDNA) 能够提高 CRISPR 介导的基因插入效率,然而也可能会对原代细胞产生毒性。因此,这种方法只能用少量双链 DNA 模板,这会导致编辑效率偏低。
研究团队发现,与之相比,单链 DNA 对细胞的毒性更低,即使是相对高浓度的单链 DNA 对细胞的毒性也比较低。在最新的研究中,团队通过在单链模板 DNA 末端添加一小段双链 DNA 突出端,这样就可以将经过修饰的 Cas9 靶序列连接到单链模板 DNA。
▲图|ssDNA CTS 模板和小分子鸡尾酒可以提高非病毒基因敲入的产量和纯度(来源:Nature Biotechnology)
“这种新方法在基因编辑效率和毒性上实现了一种巧妙的平衡。”Alex Marson 说。
研究人员发现,与双链 DNA 靶序列相比,这种新方式能够将人原代 T 细胞和其他造血细胞的基因编辑效率提高1倍以上,敲入效率和产量平均提高约 2 到 3 倍,分子的双链末端能够让研究人员可以使用 Cas9 增强非病毒载体进入细胞的能力。
然后,研究人员评估了一系列已被报道可以提高原代人 T 细胞敲入效率的小分子鸡尾酒化合物,包括DNA 依赖性蛋白激酶 (DNA-PK) 抑制剂 NU7441 和 M3814,组蛋白去乙酰化酶 I/II 类抑制剂 Trichostatin,CDC7 抑制剂 XL413 等多种化合物。他们发现这些小分子化合物能够增强同源定向修复能力,并进一步将敲入效率平均提高 2 到 3 倍左右。
论文中还写到,这种方法适用于各种目标基因位点、敲入模型和主要人类细胞类型(包括人原代T细胞),同源定向修复效率为 80%–90%。
接下来,研究团队还探索了非病毒模板的临床应用潜力,尤其是在治疗和诊断性基因替换。研究人员指出,这种新方式首次可以完全替换与罕见遗传免疫疾病相关的两个基因,即 IL2RA 和 CTLA4 基因。
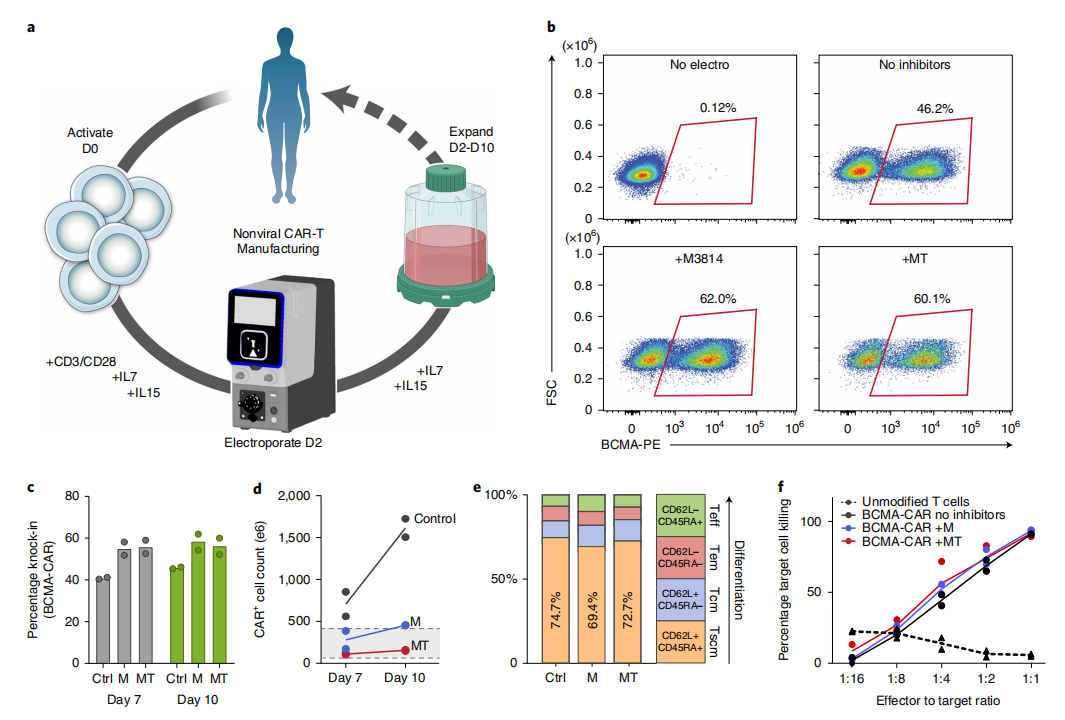
最后,研究团队还展示了一种基于完全非病毒载体生产临床级别(GMP)CAR-T 细胞的工艺,这些细胞在体外和小鼠模型中均高效清除癌细胞。
▲图|与GMP兼容的非病毒 CAR-T 细胞制造过程(来源:Nature Biotechnology)
在研究团队使用新单链 DNA 模板生产 CAR-T 细胞的过程中,第 7 天的平均敲入效率为 40.4%,第 10 天为 45.8%。第 7 天,CAR+细胞的最终产量超过 5×10^8,到第 10 天超过 1.5×10^9;T 细胞重编程为 CAR-T 细胞的转化率约为 50%,产量在患者所需的治疗疾病范围内(50-400×10^6 CAR+)。也就是说,一次操作可以设计超过 10 亿个细胞。
有望开发“下一代”基因和细胞疗法
研究团队也十分看好这种非病毒载体工程方法的临床应用潜力。Brian R. Shy 指出,使用病毒载体既昂贵又耗费资源,基因工程非病毒方法的一个主要优势是有望突破成本、制造复杂性和供应链挑战等多种限制。我们的完全非病毒策略既降低了高浓度双链 DNA 模板的毒性,也有潜力降低重编程 T 细胞的成本和流程的复杂性。
该论文的另一名作者、UCSF 助理教授兼格拉德斯通研究所副研究员 Jonathan Esensten 认为,这项技术有可能使细胞和基因疗法的开发更快、更好、成本更低。
研究团队表示,这种方式会是一种很有前景的方法,为开发下一代基因和细胞疗法提供了平台性技术。在论文中,研究团队已经展示了这种非病毒基因组工程方法在基因诊断、基因替换治疗以及合成结构(比如说靶向插入 CAR)上的潜在应用价值。
(来源:sciencenews)
比如说,利用这种新方式建立了一个完全非病毒的 T 细胞工程平台,生产了超过 10 亿个针对多发性骨髓瘤的 CAR-T 细胞。“将 DNA 模板靶向基因组中的特定位点 TRAC ,将提高 CAR-T 细胞的抗肿瘤效力。这种新的非病毒方法能够帮助大家更高效实现这一目标,这将加速下一代 CAR-T 细胞疗法的开发。”参与这项研究的一名研发人员说。
研究团队还指出,这种方法也可以拓展到其他相关的细胞类型,如造血干细胞、B 细胞和自然杀伤细胞。目前,正在进行临床前验证工作,进一步建立和优化非病毒的T细胞工程平台。
另一方面,他们还利用这种新方法改写基因突变导致罕见遗传性免疫疾病的基因序列。研究中论证了单链 DNA 模板方法应用于一系列人细胞类型的可行性,同时还可以拓展到其他应用中,包括靶向与原发性免疫缺陷病相关超 400 个基因,或者合成更多生物学结构。
“过去,科学家们已经证明可以替换特定患者发生突变的 IL2RA 基因的一小部分。现在,我们团队证明可以一次性替换整个 IL2RA 和 CTLA4 基因。这种‘一刀切除’的方法,可以治疗任何出现 IL2RA 和 CTLA4 基因突变的患者,而无需为每个患者的突变生成个性化模板。近 90% 利用这种基因工程方法修饰的细胞恢复了正常。”Alex Marson 说。
Alex Marson 在官方通稿中指出,正在推进在 CAR-T 细胞疗法和缺乏白细胞介素 2 受体 α 自身免疫疾病治疗中使用非病毒 CRISPR 技术的临床试验。