伴随着近几年的陆续获批,细胞和基因疗法也慢慢从“和声”部分迈向了“主旋律”。相比于其他疗法,细胞和基因疗法有着持久性和治愈性等特征。EHA成立于1992年,是欧洲最大的血液学组织。2019年EHA于6月13-16日在荷兰阿姆斯特丹举行,会议分享了在血液学的各项进展。我们将与大家分享EHA细胞和基因治疗的进展,包括CAR-T、肿瘤疫苗和基因治疗等。
CD19 CAR-T
众所周知,2017年美国FDA批准的两款CAR-T都是靶向CD19的,这是在大部分血液癌症中过表达的抗原。因此,目前世界上研究的CAR-T疗法有很大一部分是针对CD19的。由于EHA收录的CD19 CAR-T摘要也很多,我们挑选其中两篇进行分享。
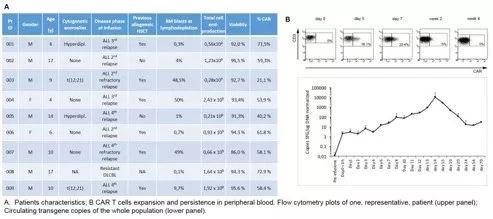
第一项关于二代CD19 CAR-T在年轻B细胞前体急性淋巴细胞白血病(BCP-ALL)和非霍奇金B细胞淋巴瘤(B-NHL)患者中的一期临床结果。
儿童复发/难治性(r/r)BCP-ALL或B-NHL的生存率还不够理想,不过靶向CD19的CAR-T疗法显示出前所未有的抗癌功效,导致了FDA和EMA对该疗法的批准。然而,治疗相关毒性特别是细胞因子释放综合症(CRS)和神经毒性是难以避免的。
研究者在罗马的OPBG医院开展了一项学术性的I/II期临床试验。使用2代CD19-CAR装载自杀基因诱导caspase-9(iC9-CD19-CAR)T细胞治疗儿童和年轻患者(1-25岁)BCP-ALL或B-NHL。该报告展示了一期临床结果。
研究开发了一种临床级、逆转录病毒、CD19特异性的CAR结构,其中4.1bb作为共刺激域,iC9作为安全开关。一期为剂量爬坡试验,部分研究连续纳入r/r BCP-ALL或B-NHL患者。测试了三种剂量水平:DL1, 0,5; DL2, 1,5; DL3, 3,0 ×106CAR+T /kg受者体重。
整个生产过程为14天,先去除白细胞然后对自体T细胞进行工程设计。所有患者均接受氟达拉滨和环磷酰胺的淋巴细胞去除方案,然后单次输注iC9-CD19-CAR T细胞。随后监测患者CAR T细胞毒性、扩张和持久性。
在2018年1月至8月期间,共有9名儿童参加了iC9-CD19-CAR T细胞治疗试验。所有剂量浓度均能在患者身上产生免疫细胞。未记录有剂量限制性毒性(DLT),最大毒性剂量(MTD)定义为3.0×106CAR+T细胞/kg。
治疗完全耐受,所有毒性完全可逆,最严重的是3-4级细胞减少,发生在所有患者中;6/9患者(66.7%)的血液毒性发生在CAR T细胞输注前,并持续到输注后。CRS发生在6/9例患者中,轻度,仅1例达到2级。值得注意的是,所有患者都没有出现神经毒性,也不需要激活iC9。
除一期的主要终点外,所有患者都进行了反应评估,7/8的BCP-ALL患者(87.5%)完全缓解(CR),包括2/3的DL1患者和5名既往造血干细胞移植失败的患者。1例CD19阴性患者在输注3个月后复发。
iC9-CD19-CAR T细胞在体内扩增,并在反应者的血液、骨髓和脑脊液中检测到。随访时间最长的患者在输注后的14个月内维持CR,通过流式细胞仪在血液中检测到iC9-CD19-CAR T细胞长达4个月【1】。
总之,iC9-CD19-CAR T细胞治疗r/r BCP-ALL是可行、安全和有效的。在该试验中,没有记录到严重的或危及生命的毒性,尽管记录到轻微的CRS,但获得了较高的CR率,这表明iC9-CD19-CAR T细胞足以介导有效的抗肿瘤作用。
第二项研究中,二代含有CD28或41BB共刺激区的CD19 CAR-T细胞疗法已经证明在r/r NHL患者的长期CR为40-50%,CLL患者的长期CR率为20-30%。但在NHL特别是CLL中的表现不佳可能是由于T细胞在抑制性肿瘤微环境中的增殖和细胞溶解活性不足所致。
之前已证明,4-1BBLl与其同源受体的结合,比19-28z、19-41BBz和1928BBz更能增强T细胞的增殖、存活、IL-2分泌和细胞溶解活性。本文报告了用递增剂量的自体19-28z/4-1BBL+ CAR T细胞治疗CLL和NHL成年患者的最新研究结果。
本研究的主要终点是确定1928z-41BBL CAR T细胞对复发或难治性CD19+血液恶性肿瘤患者的毒性和MTD。次要终点的是评估CAR T细胞的抗肿瘤效果和体内持久性。扩展终点是评估MRD水平和CAR T细胞对内源性抗肿瘤免疫反应和细胞因子肿瘤微环境变化的影响。
招募的患者包括r/r NHL和CLL。患者接受了环磷酰胺(Cy)单独或联合氟达拉滨(Flu)的条件化疗,随后进行CAR T剂量爬坡。注射剂量分别为:DL1 1x105CAR T 细胞/kg,DL2 3 x 105CAR T 细胞/kg,DL3 1x 106CAR T 细胞/kg和DL4 3x 106CAR T 细胞/kg。
试验共招募28名患者,包括9例CLL,9例全新DLBCL,3例tFL,4例FL和WM,3例Richter’s transformation和1例B-ALL。平均年龄为70岁(53-81岁),之前治疗的中位数为5(2-17)。接受DL1-DL4的患者数分别为3、3、3和19。
未观察到DLT,所有28例患者至少在T细胞输注后2周,可评估毒性。总的来说,11名患者出现CRS(39.3%),主要为1级(n=6)和2级(n=4),11名患者(39.3%)出现神经毒性(NTX),其中8名患者为1-2级,3名为3级。
28例患者中有16例(57%)达到CR,其中大细胞淋巴瘤中有7例(78%),FL3有2例(67%),CLL有3例(30%),Richter’s transformation有2例(67%),1例B-ALL。WM患者达到VGPR。
中位随访169天(24-534天),仍有8例(29%)为CR。T细胞输注后9天(2-82)的中位数出现峰值T细胞扩张。160天后依然能在患者体内检测到CAR T细胞【2】。
总之19-28z/41BBL CAR T治疗是安全的。未观察到严重的CRS,8%的患者出现严重的NTX。但57%的总CR率是鼓舞人心的,大细胞淋巴瘤患者(78%)的CR率高于CLL患者(20%),不过由于患者数量较少不能盖棺定论。有可能CLL需要更高剂量或更早介入治疗。
其他CAR-T
除了靶向CD19外,其他靶点也进行得如火如荼。在此,我们将挑选今年EHA的两篇临床报道,针对不同靶点,分享其在血液疾病中的研究进展。
第一项关于靶向CD22的CAR-T疗法。尽管CD19-CAR T细胞治疗r/r B-ALL在世界范围内有很好的临床效果,但这种治疗后的复发与预后较差有关,已成为亟待解决的问题。因此需要新的治疗方法。
这项研究的目的是目的评价CD22 CAR-T(22-CAR T)治疗34例r/r B-ALL的疗效和安全性。34名患者被纳入北京博仁医院,平均年龄10岁(1-55)。34例(38%)患者中有13例曾接受异基因造血干细胞移植(allo-HCT)。
11例患者(32%)有常见髓外疾病(EMD),其中4例(12%)为局限性EMD。25名患者(74%)出现血液复发(HR),中位骨髓母细胞数为63.8%(5%-97%)。5名患者(15%)有FCM-MRD+,骨髓母细胞中位数为3%(0.3%-5%)。31/34例患者经19-CAR T细胞治疗失败。
所有患者都表达CD22。这是一个慢病毒携带的二代CD22 CAR-T,包括抗CD22 ScFv、4-1BB共刺激和CD3z信号域。非移植组CD22 CAR-T细胞平均输注剂量为7.5(0.3-34.7)×105/kg,移植组为1(0.2-10)×105/kg。
在第12至15天检测到CAR-T细胞的扩增峰值(1.8-2200倍)。4名患者在CAR-T细胞治疗后30天内死亡,其中1名患者死于5级CRS;1名患者在第29天死于VOD;2名患者死于严重感染。
在存活30天或更长时间并进行反应评估的30例患者中,24例(80%)达到CR/CRi。在21例基线血液复发的患者中,19例(90%)达到CR/CRi,18例(86%)达到FCM-MRD。在5例FCM-MRD+患者中,3例(60%)变为FCM-MRD-。在4例仅有EMD的患者中,2例(50%)达到CR,1例患者的EMD部分降低。
CRS发生31/34例患者中(91.2%),30例患者为轻度或中度(1级或2级)。5/34例患者中出现1级神经毒性。一名患者出现2级神经毒性,通过干预进行治疗,并很快完全消除。
中位随访时间为11.5个月,22-CAR T细胞治疗55(40~70)天后,11例患者转向治疗,1年的DFS为71.6%。其中8名未接受其他治疗的患者,3例在6、6.6和14个月保持CR,另外5例复发的中位时间为3.4个月(1.7-6)【3】。
总之,这项研究表明CD22-CAR T细胞能够达到B-ALL患者的高缓解率,这些患者在化疗、移植甚至19-CAR T细胞治疗后都难以治愈或复发。虽然在没有额外治疗的情况下,22-CAR T细胞治疗后的复发率很高,但是在CAR T细胞治疗后与allo-HCT桥接可以降低复发率。
第二项关于NKG2D CAR-T研究。CYAD-01是以融合到CD3ζ胞内结构域的NKG2D受体为基础的CAR-T细胞,能结合多种恶性肿瘤(包括AML和MDS)表达的配体(MICA/B, ULBP1-6)。该研究目的是为了确定CYAD-01的最佳临床治疗方案。
一期THINK试验评估了在各种恶性肿瘤(包括r/r AML、MDS和MM)中不经预处理的多次CYAD‑01输注的安全性和临床活性。3个剂量水平(DL)得到评估(3 x 108, 1x 109和 3x 109T细胞)。第一个治疗周期包括每2周3次CYAD-01输注和第二个周期3次CYAD-01 输注,第一个周期后无PD,则间隔2周。
I/II期DEPLETHINK研究评估了环磷酰胺和氟达拉滨预处理后1次CYAD-01输注对有r/r AML/MDS患者的安全性和初步疗效。评估了3个剂量(1x 108, 3x 108和1x 109细胞)和预处理和CYAD-01输注之间的2次间隔。
THINK研究结果:16名患者被纳入到剂量爬坡试验,4名患者被纳入密集试验中。共有7名患者出现3/4级TRAE。CRS发生在10例患者中,2例G3-CRS(DL2)和1例G4-CRS(DL3),这两种症状通过早期的Tocilizumab治疗得以解决。未观察到治疗相关的神经毒性AE。
12名剂量爬坡接受至少3次CYAD-01输注的患者中,2名有MM患者没有临床响应。对于r/r AML/MDS的患者,4/10的患者在29天时有OR。其中一例r/r AML患者在DL1下达到CR和部分血液学恢复(CRh)并持续16个月。另外在DL1和DL3情况下,2例AML患者达到CR伴随不完全血液恢复(CRi)持续一个月;DL3下1例MDS患者达到骨髓CR(mCR)。
2例DL2 AML患者达到SD,第一个治疗周期骨髓(BM)成纤维细胞百分比下降,第二个治疗周期进一步下降。另外两个DL3 AML患者至少在2个月内达到SD;2名AML患者没有临床反应的证据。
DEPLETHINK结果:在前2个研究组中,6名患者入选,评估了1x 108细胞治疗。总的来说,观察到3个G3/4 TRAE。4例患者出现5例CRS:第一次输注后3例G1/2,第二个治疗周期中2例CRS(1例G4-CRS和1例G1),用tocilizumab治疗后缓解。第一个治疗组中,2名患者36天达到SD,可以开始第二周期3次CYAD-01输注【4】。
总之,到目前为止,两个一期试验的结果表明,在r/r血液恶性肿瘤患者中,无论是否预处理化疗,CYAD-01都是安全的。在THINK研究中,r/r AML/MDS的患者在29天OR为40%。DEPLETHINK研究仍处于数据积累阶段。
基因治疗
近年来,基因治疗异军突起,特别在某些罕见病领域。相比其他疗法,某些致病机理明确的疾病基因治疗有更高的治愈能力。当然,基因治疗的价格也是让人望而却步,数以百万美元的治疗费用也让不少药物折戟于市场。
接下来我们介绍两项今年EHA中基因治疗的进展。
第一项关于输血依赖性β-地中海贫血症(TDT)的基因治疗三期临床。TDT是一种严重的遗传性疾病,通常通过常规的终生红细胞(RBC)输血进行治疗,可能导致严重的并发症和器官损伤。
大多数TDT患者不适合异基因造血干细胞(HSC)移植。目前正在研究TDT患者的LentiGlobin基因疗法,包含体外转导的自体CD34+ HSCs和编码T87Q氨基酸替代的β-珠蛋白的BB305慢病毒载体(LVV)。
在进行中的国际单臂Northstar-2三期研究(HGB-207;NCT02906202)中,对TDT(≥100 ml/kg/年 RBC或≥8 RBC输注/年)和非β0/β0基因型的儿科、青少年和成人患者进行LentiGlobin基因治疗。
患者在注入转导细胞前接受特定剂量的白消安进行清髓。主要终点是输血独立性【TI,加权平均血红蛋白(HB)≥9 g/dl,无红细胞输注时间≥12个月】。对患者进行2年随访,并参与长期随访研究。
截至2018年9月14日,Northstar-2共治疗了16名患者。平均年龄19岁(8-34),其中2例<12岁。中性粒细胞和血小板植入的中位时间分别为19(13-32)天和44.5(20-84)天。在最近的数据分析中,1名患者(1个月随访)和4名患者(≤2个月随访)未分别实现中性粒细胞和血小板植入。
非血液学分级≥3例患者发生的不良事件包括口炎、发热性中性粒细胞减少、鼻出血、发热和肝静脉闭塞性疾病(VOD)。一个3级血小板减少的事件被认为可能与LentiGlobin治疗相关。没有移植失败、死亡、检测到载体介导的复制活性慢病毒或插入突变。
在3名可评估的患者中,2名患者满足了TI的主要终点。11例随访3个月以上的患者中有10例停止了红细胞输注。在最后一次研究访问中,这10名患者的总血红蛋白水平为11.1-13.3 g/dl,包括7.7-10.6 g/dl基因治疗衍生的Hb和HbAT87Q。
在输注LentiGlobin 6个月、9个月和12个月后,血红蛋白水平保持稳定,平均值分别为11.9 g/dl(n=9)、12.2 g/dl(n=7)和12.3 g/dl(n=5)。为了评估红细胞生成障碍的纠正情况,对6例随访12个月以上的患者的骨髓样本进行细胞数量和髓系红细胞比(M:E)评估。
与基线水平(0.18-0.45)相比,停止RBC输注的5名患者在第12个月(0.77-1.1)的M:E比率均有所改善。这4/5名患者在第12个月时具有可溶性转铁蛋白受体水平,与基线相比(中位数173.5;90.6-235.3 nmol/l)表现出下降(中位数45.3;37.7-69.4 nmol/l)【5】。
在Northstar-2中,LentiGlobin基因治疗的安全性与之前有关白消安条件作用的经验基本一致。部分患者出现血小板植入延迟。11例随访3个月以上的患者中有10例在接受LentiGlobin治疗后停止了慢性红细胞输注。总Hb稳定在接近正常水平,骨髓形态显示红细胞生成改善。
第二项关于基因治疗在镰刀型贫血(SCD)上的应用。β-珠蛋白基因转移可调控SCD的临床表达,甚至可纠正其表达。治疗分为三组:A组,骨髓来源HSCs;B组:方案改良组;C组:plerixafor动员HSCs方案改良组。
改研究目的是描述正在进行的HGB-206研究中,C组患者使用LentiGlobin治疗的安全性和有效性。在收集HSC之前,C组患者接受了2个月以上的RBC输注,目标Hb为10-12 g/dl,HbS小于总Hb的30%。
在240微克/千克plerixafor后4-6小时,通过单采收集CD34+ HSCs,并用BB305 LVV进行转导。通过白消安清髓后,注入细胞,监测患者的不良事件、植入物、HbAT87Q水平和溶血标记物。
截至2018年9月14日,9名C组患者接受了LentiGlobin治疗,随访5.2(0.5–9.2)个月。载体拷贝数为3.8(2.8–5.6),细胞剂量为6.5(3–8)106CD34+细胞/kg,转导81%(68–90%)CD34+细胞。
截至2018年9月14日,8名患者和7名患者分别在20(18–24)天和28(19–136)天完成了中性粒细胞和血小板植入。输注后最常见的非血液学分级为发热性中性粒细胞减少症(n=6)和口炎(n=6)。
无输注相关和静脉闭塞性肝病的AE或移植失败报告。截至数据输出日期,输注后无血管阻塞事件。早期数据显示没有克隆优势或载体介导的复制活性慢病毒。在8例随访时间≥1个月的患者中,最后一次访视时HbAT87Q的中位数为4.6(2.5-8.2)g/dl。
在4例随访6个月以上的患者中,无红细胞输注的总血红蛋白为9.9-13.7 g/dl,47-60%的患者中有HbAT87Q,几乎等于或超过了HbS水平(总血红蛋白的38-49%)。
基线网织红细胞计数、总胆红素和乳酸脱氢酶分别为380(349-415)x109/L(n=4)、56(29-86)umol/L(n=9)和354(226-738)u/L(n=7),最后一次访视的中位数分别下降了64%、70%和45%。用抗βS抗体研究红细胞中HbAT87Q表达的探索性试验的初步数据表明HbAT87Q在全细胞中的分布【6】。
在C组实施方案变更(包括使用plerixafor治疗动员的HSCs)后,在6个月以上的随访中,HbAT87Q的水平几乎等于或超过HbS水平。LentiGlobin在SCD中的安全性与已知的HSC收集和清髓的副作用一致。根据修订方案和纳入青少年的额外患者的数据将有助于评估LentiGlobin对SCD的临床影响。
肿瘤疫苗
接下来讲两项树突细胞(DC)疫苗的进展。第一项关于DC疫苗在多发性骨髓瘤中的进展应用。美国国家癌症研究所的最新数据显示,骨髓瘤患者的5年存活率为50%,意味着仍然有不少临床需求去提高存活率。
DC细胞已在临床试验中用作肿瘤患者治疗性疫苗接种的细胞介质。主要有两个趋势:提高下一代DC细胞疫苗的免疫原性,以及DC细胞疫苗与其他癌症治疗相结合的新模式。
Antwerp的DC细胞骨髓瘤项目是一系列临床试验的一部分,用于治疗急性髓细胞白血病、间皮瘤、胶质母细胞瘤和多发性硬化症等医疗需求未得到满足的疾病。
共8名骨髓瘤患者接种了疫苗。有些人有高风险的细胞遗传学,其他人没有。平均年龄为55岁,是最需要更好和更强治疗的患者群体。经白细胞去除、CD14选择和6天培养后,疫苗与WT1抗原一起孵育。
在门诊部,通过腋窝淋巴结附近的皮内注射,接种1000万DC疫苗。疫苗每周2次,最少4次。为了监测血液学反应,在接种4次疫苗前后进行了骨髓活检。为了进行免疫监测,在接种4次疫苗后进行了迟发型超敏反应试验。
最终可以给出12个疫苗接种的中位数。8例均为迟发型超敏试验阳性。结果显示4例患者获得SD,1例患者严格CR,3例患者从CR转变为严格CR。总生存期中位数为10.5年(5- 13)。其中3个病人依然存活。疫苗接种开始后的总生存期中位数为4.5年【7】。
所有患者均有DC细胞疫苗特异性T细胞免疫应答的诱导,5年总生存率为100%。DC细胞疫苗生产一周,总成本为25000欧元,与其他免疫疗法相比,树突状细胞疫苗是社会经济负担得起的治疗方案。一个重要的问题是疫苗接种在整个治疗方案中的时机,特别是在新的CAR-T细胞治疗时代。
最后一项关于DC疫苗在预防AML复发中的应用。不具备HSCT资格的AML患者,由于缺乏长期疾病控制,其疾病复发的风险显著。
为了研究初始化疗后预防复发的可能性,目前正在使用DC细胞进行一项安全和可行性的I/II阶段试验(NCT02405338),该试验采用3至4天的快速生产方案生成。该产品使用RNA电击编码全长蛋白抗原PRAME(优先表达黑色素瘤中的抗原)和WT-1(Wilm肿瘤1抗原),以及一种含有TLR-7/8激动剂的混合物。
提供的数据反映了1年随访时间点的中期分析结果,同时疫苗接种继续进行,直到所有患者在2年随访中达到试验结束。
共有20名受试者(平均年龄59岁,24-73岁)患有AML(风险组:好、中、差:13、5、2)。入组标准为:在形态上完全缓解或完全缓解,在诱导或巩固治疗后血液学恢复不完全,不符合异基因HSCT要求的患者。
受试者必须WT-1呈阳性,无论是否PRAME呈阳性。每月进行一次DC疫苗接种,最初6周频率更高。AML诊断是在第一次疫苗接种前9.8个月(4.5-17.5),最后一次化疗输注是在6.9个月(2-14.8)中间进行的。
在这些化疗前处理的受试者中制备DC疫苗对所有20名患者都是可行的,每次接种都使用5-10 x 106细胞。疫苗接种耐受性良好,无与治疗相关的严重不良事件(SAES)。AE都比较温和(1级)。
共记录3个3级不良事件,不太可能或与治疗无关:1例带状疱疹感染、1例上呼吸道感染和3例血小板计数下降。所有三例血小板计数的下降都是由于白血病复发所致。
治疗12个月后,总生存率为89%(18/20,95%CI:61-97%),无进展生存率为60%(12/20,95%CI:36-78%)。大多数复发(5/8)发生在疫苗接种开始后的前80天内,其中2例死亡发生在第45天和第64天复发的患者中,这可能表明进入研究后开始复发【8】。
综上所述,在1年的随访时间内,对WT-1和PRAME进行DC疫苗接种似乎是安全可行的,可用于预防AML复发。
小结
CAR-T、CAR-NK、TCR-T等细胞治疗的兴起为恶性血液疾病带来了革命性的变化,也是治疗人类癌症打开了一扇新的窗户。虽然目前这些疗法比较局限,特别在实体瘤中还难以展现其疗效,加之高昂的治疗费用也让人望而却步。但是技术的发展和成熟终究会使越来越多的人受益,成本的降低也只是时间的问题。更多临床进展给我们提供了更多深入了解这些技术的机会,也有助于患者对治疗方法的选择。
参考文献:
【1】Francesca Del Bufalo, Pietro Merli, Luciana Vinti, Mattia Algeri, Maria Giuseppina Cefalo, Valentina Bertaina, Giuseppina Li Pira, Ignazio Caruana, Biagio De Angelis, Iolanda Boffa, Stefano De Cecca, Domenico Orlando, Marika Guercio, Matilde Sinibaldi, Zeinab Abbaszadeh, Vinicia Assunta Polito, Rosaria Cristantielli, Concetta Quintarelli, Franco Locatelli. ACADEMIC, PHASE1 TRIAL ON T CELLS EXPRESSING BOTH CD19 CHIMERIC ANTIGEN RECEPTOR AND INDUCIBLE CASPASE 9 SAFETY SWITCH FOR TREATMENT OF CHILDHOOD ACUTE LYMPHOBLASTIC LEUKAEMIA AND NON-HODGKIN LYMPHOMA. Abstract: S1635.
【2】M. Lia Palomba, Connie Batlevi, Isabelle Riviere, Brigitte Senechal, Xyuian Wang, Jenny Yang, Peter Kane, Yvette Bernal, Richard R. Furman, Claudia Diamonte, Elizabeth Halton, John Pineda, Brentjens Renier, Michel Sadelain, Park Jae. A PHASE I FIRST-IN-HUMAN CLINICAL TRIAL OF CD19-TARGETED 19-28Z/4-1BBL “ARMORED” CAR T CELLS IN PATIENTS WITH RELAPSED OR REFRACTORY NHL AND CLL INCLUDING RICHTER TRANSFORMATION. Abstract: S1634.
【3】Jing Pan, BIPING DENG, Shuangyou Liu, Tong Wu, Zhiyong Gao, Yuehui Lin, Yongqiang Zhao, Yan Zhang, Xiyou Tan, Alex H. Chang, Chunrong Tong. CD22 CAR T-CELL THERAPY IN 34 REFRACTORY OR RELAPSED B ACUTE LYMPHOBLASTIC LEUKEMIA PATIENTS. Abstract: PS1211.
【4】David A. Sallman, Marco Davila, Jason B. Brayer, Tessa Kerre, Xavier Poiré, Violaine Havelange, Philippe Lewalle, Samer Al-Homsi, Enkhtsetseg Purev, Eunice S. Wang, Panagiota A. Sotiropoulou, Nathalie Braun, Caroline Lonez, Anne Flament. UPDATED RESULTS FROM PHASE I TRIALS ASSESSING A NKG2D CAR T-CELL APPROACH IN RELAPSED/REFRACTORY ACUTE MYELOID LEUKEMIA AND MYELODYSPLASTIC SYNDROME PATIENTS. Abstract: PS1212.
【5】Franco Locatelli, Alexis A. Thompson, Suradej Hongeng, John B. Porter, Martin G. Sauer, Janet L. Kwiatkowski, Adrian J. Thrasher, Isabelle Thuret, Heidi Elliot, Ge Tao, Richard A. Colvin, Mark C. Walters. SAFETY AND EFFICACY OF LENTIGLOBIN GENE THERAPY IN PATIENTS WITH TRANSFUSION-DEPENDENT B-THALASSAEMIA AND NON-B0/B0 GENOTYPES IN THE PHASE 3 NORTHSTAR-2 STUDY. Abstract: S1632.
【6】Julie Kanter, Alexis A. Thompson, Markus Y. Mapara, Janet L. Kwiatkowski, Lakshmanan Krishnamurti, Manfred Schmidt, Alexandra L. Miller, Francis J. Pierciey, Wenmei Huang, Jean-Antoine Ribeil, Mark C. Walters, John F. Tisdale. UPDATED RESULTS FROM THE HGB-206 STUDY IN PATIENTS WITH SEVERE SICKLE CELL DISEASE TREATED UNDER A REVISED PROTOCOL WITH LENTIGLOBIN GENE THERAPY USING PLERIXAFOR-MOBILISED HAEMATOPOIETIC STEM CELLS. Abstract: S1633.
【7】Ann Van de Velde, Kirsten Saevels, Irma Vandenbosch, Alain Gadisseur, Anke Verlinden, Evelien Smits, Sébastien Anguille, Wilfried Schroyens, Zwi Berneman. AUTOLOGOUS DENDRITIC CELL VACCINATION TO PREVENT PROGRESSION AND RELAPSE IN MULTIPLE MYELOMA. Abstract: PS1218.
【8】Yngvar Fløisand, Iris Bigalke, Dag Josefsen, Christiane Geiger, Kai Pinkernell, Gunnar Kvalheim. INTERIM ANALYSIS OF A WT-1 AND PRAME ‘FAST-DC’ VACCINE SHOWS SAFETY AS ACTIVE IMMMUNOTHERAPY FOR THE PREVENTION OF AML RELAPSE. Abstract: PS1223
相关延伸阅读
新型CAR-T,可消除小鼠胶质母细胞瘤,却多次被NIH拒绝?
Norbert Bischofberger从MIT获得平台技术的亿轮融资
谈判药品价格而不限制患者使用:德国的经验















