所有的生命体都形成了高度复杂的传感器系统,以检测“自我”和“非我”核酸(Nucleic acids,NA)。在脊椎动物中,NA传感器通过检测病原体、稳态失衡和损伤,来诱导适当的反应来消除病原体,重建体内平衡来保护机体的完整性。
效应机制包括:
i)免疫信号传导,
ii)限制NA功能,如抑制mRNA翻译
iii)细胞死亡途径。
适当的效应器反应是宿主防御的必要条件,但调节失调的NA感知可能会导致毁灭性的自身免疫性和自身炎症性疾病。
稳态条件下的自我NA和发生改变或者外源性的NA在生化本质上是相似的,因而区分二者具有挑战性。
核酸传感器
与其他外源性的微生物物质(如鞭毛蛋白或LPS)不同,核酸在所有形式的生命中都存在,无论是病原体还是宿主。因此,有效的NA感知,关键取决于特异性和敏感性。核心原则是NA(1) 结构、(2)定位 (3)可用性
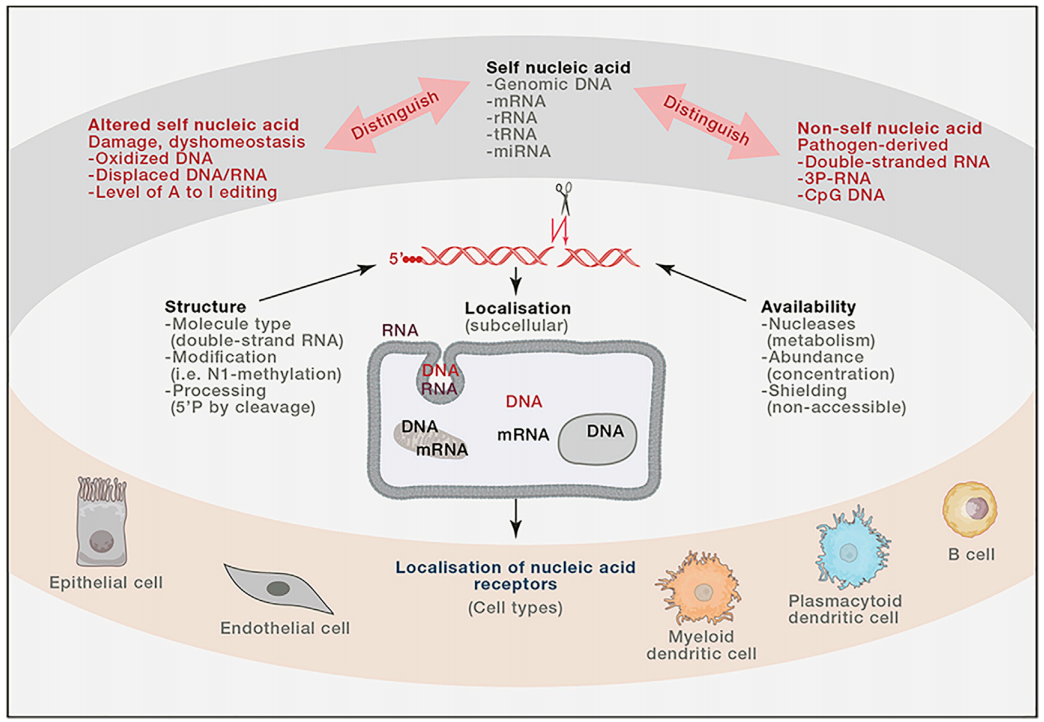
NA的结构特征包括其长度、碱基配对、二级结构、5‘端和3’端以及修饰。
NA的定位是指它们的细胞和亚细胞的定位,由战略放置的NA传感器系统监控。
内体NA传感器 ,即NA感知TLR,主要表达在吞噬细胞和专业免疫细胞,理想地位于感知内吞体水解释放的病原体配体。这个过程由内体运输和水解受体的位置决定,这些受体位置发生改变则引起自身免疫性疾病。
细胞质NA传感器 ,包括RIG-I、MDA5和CGAS,在有核细胞中广泛表达,它们感知细胞内在感染。
1型IFN受体 (IFNAR)也广泛表达,理论上允许任何有核细胞感知病毒感染,并通过自分泌或旁分泌IFN进入抗病毒状态。
核NA 感知非常重要,最近的研究修正了长期以来的细胞核“享有免疫特权”。事实上,考虑到细胞核是大多数DNA病毒被复制的部位,以及逆转录病毒的基因组整合,这些核传感器可能是保护我们的基因组完整性的最后一道防线。
NA可用性 是指进入特定隔间中的NA与被隔离(例如通过病原体液泡)、被受体结合屏蔽(例如通过病毒蛋白)或通过核酸酶降解的NA之间的净值。宿主体内的核酶 (e.g., DNase 2, RNase T2) 通过调节NA的量,调控部分受体激活,而其他受体不被激活,充当了NA传感器的调控因子。
异常的、不受控制的自身NA的感知,可以引起自身免疫性疾病。尽管如此,NA感受器依旧是机体识别外源性微生物最主要的机制。
RNA的感知和反应
TLR3 是一个序列非依赖性的感受器,识别大于35bp dsRNA磷酸核糖及不完整的dsRNA stem结构。TLRs通过TRIF诱导IFN-β和NF-κB信号。
TLR7,8 识别RNA降解产物,第一个口袋结合鸟苷和尿苷(分别为TLR7和TLR8),和第二个口袋结合短二或三核苷酸。
TLR8的激活需要上游内小体RNA酶活性(RNaseT2,RNase2),由于同源性,RNA酶活性可能也需要TLR7。TLR7的激活通过MyD88-TRAF6-IRF7通路诱导IFN-a。TLR8的激活通过TAK1-IKKb-IRF5途径释放IFN-β和促炎细胞因子。
TLR适配器与溶酶体(TASL)上的SLC15A4相互作用,被认为是连接内溶酶体与TLR7和8的信号。
TLR13 以序列特异性的方式识别细菌23SrRNA。激活后,细胞质免疫传感器RIG-I和MDA-5低聚,从而诱导MAVS聚合成纤维柱结构,招募TRAF2、TRAF6、IKK和TBK1,然后激活NF-KB和IRF3和/或IRF7信号。
MAVS 复合物可与FADD、RIP1和Caspase 8相联,并诱导MAVS下游的细胞凋亡信号。DDX3、DHX15、DHX36和DDX60都增强了RIG-I信号。DHX29是RIG-I和MDA5的共受体,LGP2支持通过MDA5形成纤维,但可能与RIG-I竞争配体。
抗病毒活性的细胞质RNA传感器: PKR (蛋白激酶R磷酸化elF2a)和 OAS (2‘-50-寡腺苷酸合成酶系统),抑制病毒和宿主mRNA的Cap依赖性翻译。PKR和OAS均结合大于30bp的dsRNA,包括polyI:C.。
OAS诱导2‘5’ 寡腺苷酸的形成,寡腺苷酸作为第二信使激活核糖核酸酶L(RNaseL),反过来将细胞RNA和病毒RNA降解为较小的RNA分子,可以由RIG-I和DHX33感知。DHX33激活NLRP3炎性小体,诱导焦亡。
干扰素诱导三角形四肽重复蛋白( IFIT )可以感知病毒RNA的5‘末端,阻止其翻译。IFIT1结合Cap0((7mmpppNN)结构的RNA,IFIT1B结合Cap0,较小程度结合Cap1(7mmpppNmN),不结合含Cap2(7mGpppNmNm)的RNA。IFIT2结合富含AU的RNA。
DDX17 可以结合一些RNA病毒的茎环结构。
作用于RNA1的腺苷脱氨酶( (ADAR1 )催化腺苷,在碱基配对区域的C6脱氨化为氨酸,由此产生的非同义编码导致氨基酸取代,并可能使病毒蛋白不发挥作用。
宿主RNA衰变机制包括无意义密码子介导的mRNA降解(nonsense-mediated mRNA decay, NMD )、5’-3‘RNA降解和3’-5‘RNA外切酶机制。NMD靶向长3’UTR的mRNA转录,但也能感知病毒RNA。
5‘-3’降解机制(脱帽酶DCP1和DCP2;和5‘-3’外切酶XRN1(XRN-DCPs)参与)参与生理性细胞mRNA更换,也展现出抗病毒活性。
超杀伤抗病毒活性2样(SKIV2L)和锌指抗病毒蛋白(ZAP)支持将vRNA结合并转运到RNA外泌体,进行降解。
ISG和病毒限制性因子Z-DNA结合蛋白1(ZBP-1)是dsRNA传感下游的一种死亡受体。
ZBP-1激活多种程序性细胞死亡途径,包括焦亡、细胞凋亡和坏死,称为PAN-凋亡。在dsRNA结合后,ZBP-1与caspase6支持的RIPK3相互作用,导致MLKL激活和坏死,caspase 8诱导的细胞凋亡,NLRP3依赖炎症小体和焦亡。三种构建炎症小体的NLRs参与细胞质RNA传感:通过NLRP3的DHX33、通过NLRP9b的RNA解旋酶DHX9,和支持RIG-I样螺旋酶的辅助蛋白DHX15。
DNA感知和反应
TLR9的信号传导局限于内溶酶体,并优先检测含有非甲基化CpG基序的ssDNA,在细菌DNA较真核DNA常见。TLR9有两个结合位点,一个位点与非甲基化CpG的ssDNA结合,另一个与携带5‘羟基的短ssDNA结合,两者协同促进TLR9二聚和信号传导。
TLR9配体被内溶酶体DNaseII、PLD3和PLD4紧密调控,它们协调降解单链和双链DNA。细胞质DNA传感包括RNA传感器 RIG-I ,它检测由从poly(dA:dT)转录的RNA。
cGAS/STING 是主要的细胞质dsDNA传感器,激活I型IFN反应和NLRP3依赖性炎症小体反应。该途径的细胞质DNA的可用性由DNaseIII(TREX1)调节。
cGAS的附件蛋白(HMGB1,G3BP1、TFAM和ZCCHC3),它们结合、弯曲和稳定dsDNA。cGAS定位在细胞核中,在那里它感觉外来,但不是自我DNA。在这里,NONO、HMGB1和TFAM,帮助DNA与CGAS结合。
IFI16 是一种核限制因子,结合和沉默病毒或转染的DNA。
DNA依赖蛋白激酶 (DNA-DK) 的DNA传感,是独立于STING之外的传感器,感知线性DNA,通过IRF3/IRF7和HSPA8/HSC70发送信号。
AIM2 是负责炎症小体激活的主要细胞质dsDNA传感器。
APOBEC 是一个限制因子,第一条链执行C到U的突变,第二条链执行G到A的突变。
SAMHD1 是一种脱氧核苷三磷酸(dNTP)三磷酸水解酶,从dNTP中去除三多磷酸部分,从而降低细胞内DNTP浓度并抑制逆转录。


