来源
国外医药抗生素分册 2019年5月第40卷第3期
作者
汪阿鹏,冯连顺,编写,刘明亮,郭慧元,审校
中国医学科学院北京协和医学院医药生物技术研究所
摘要
氟喹诺酮类抗菌药具有抗菌谱广、杀菌活性强、毒性低及疗效高等诸多优点,在临床上广泛用于各种细菌感染的治疗。
然而,长时间的使用甚至滥用,细菌已通过突变和染色体介导等途径对这类药物产生了严重的耐药性。
因此,亟需开发对耐药菌有效的新型氟喹诺酮抗菌药。氟喹诺酮的C-7位取代基与抗菌谱、抗菌活性、药代动力学性质和安全性等息息相关,被认为是最适合修饰的位点。
事实上,近年来上市的新氟喹诺酮类抗菌药绝大多数是对此位点修饰的成果。
此外,向氟喹诺酮的C-7位引入大体积的取代基并不会影响此类化合物的渗透性,故向此位点引入其它药效团的杂合体策略引起了研究人员的广泛兴趣。氟喹诺酮杂合体可能具有双重作用机制,对耐药菌和厌氧菌具有潜在的活性。
特别值得一提的是,多个氟喹诺酮杂合体如利福霉素-氟喹诺酮杂合体CBR-2092和β-内酰胺-氟喹诺酮杂合体Ro-23-9424等目前正处于临床评价阶段,有望于不久的将来为人类健康服务。
本文将着重介绍近年来氟喹诺酮类化合物尤其是杂合体在抗菌领域的最新研究进展,并归纳此类药物的构-效关系,以启迪科学家设计活性更高的候选物。
关键词
氟喹诺酮;抗菌药;耐药菌;构-效关系
前言 |
随着抗菌素的广泛、长期使用甚至滥用,细菌包括革兰阳性菌、阴性菌和其它致病菌对几乎所有的抗生素均产生了不同程度的耐药性。耐药菌的不断涌现和在世界范围内的广泛传播不仅已成为临床医师所必需经常面对的棘手问题,而且因此丧命的患者人数不断攀升。
因此,研发对药敏型和耐药型致病菌具有活性的新型抗生素迫在眉睫。首个喹诺酮--萘啶酸(1)是1962年Lesher等在合成抗疟疾药物氯喹时偶然发现的副产品,本品对大肠埃希菌、克雷伯菌属、变形杆菌属、肠杆菌属等革兰阴性菌具有中等强度的活性。
本品于1964年用于临床治疗敏感革兰阴性菌所致的尿路感染,但因抗菌谱窄和易产生耐药性等缺陷目前已退出市场。
自上世纪80年代初,Koga等结合吡哌酸和氟甲喹的结构特征成功开发出6-氟-7-哌嗪基取代的诺氟沙星(首个氟喹诺酮, 喹诺酮发展史上具有划时代意义的品种)以来,这类药物发展到了全新阶段。
研究证实,C-6位的氟原子可以增强此类化合物对DNA促旋酶的抑制作用和提高对细胞膜的渗透性,进而增强抗菌活性,故目前临床上使用的喹诺酮类抗菌药绝大多数属于氟喹诺酮类。
目前,氟喹诺酮在临床上主要用于治疗上、下呼吸道感染、胃肠道感染、妇科感染、性传播疾病、前列腺炎、骨关节感染、皮肤和软组织感染等。
除经典的抗菌活性外,氟喹诺酮还具有抗肿瘤、抗结核、抗人类免疫缺陷病毒(HIV)、抗疟疾和抗阿尔茨海默病等多种非经典生物活性,引起了药物化学家的普遍关注。
氟喹诺酮结构骨架可供修饰的位点较多,近年来药物化学家对其进行了系统而广泛的结构修饰。
其中,氟喹诺酮的C-7位取代基与抗菌谱、抗菌活性、药代动力学性质和安全性等密切相关,被认为是最适合修饰的位点。
最近,将其它活性分子或药效团通过适当的连接子揉合到氟喹诺酮C-7位的杂合体策略引起了科学家的广泛关注。
杂合体分子不仅可能具有双重或多重作用机制增强对耐药菌的活性,还具有拓展抗菌谱、改善药代动力学和减少毒副作用的潜质。
目前,多个氟喹诺酮杂合体如利福霉素-氟喹诺酮杂合体CBR-2092和β-内酰胺-氟喹诺酮杂合体Ro-23-9424等目前正处于临床评价阶段,有望于不久的将来为人类健康服务。
本文将着重介绍近年来氟喹诺酮类化合物尤其是氟喹诺酮杂合体在抗菌领域的最新研究进展,并归纳此类药物的构-效关系(SAR),以启迪科学家设计活性更高的候选物。
1
喹诺酮发展史
经过50余年的发展,喹诺酮类药物发展到现在已有四代。总体而言,新一代喹诺酮的抗菌谱比前一代更广、活性更高。
第一代喹诺酮(见图1)除萘啶酸(1)外,还有噁喹酸(2)、吡哌酸(3)和罗索沙星(4)等。

这些喹诺酮对革兰阴性菌有相当的活性,故临床上主要用于治疗敏感革兰阴性菌所引起的尿路感染。
但第一代喹诺酮存在着肾消除快、抗菌谱窄等诸多缺点,目前已极少使用。
第二代~第四代喹诺酮主要为氟喹诺酮,其中第二代喹诺酮(见图2)包括诺氟沙星(5)、环丙沙星(6)、依诺沙星(7)、培氟沙星(8)、洛美沙星(9)、那氟沙星(10)、芦氟沙星(11)和氧氟沙星(12)等。
第二代喹诺酮由于氟原子的引入抗菌谱拓展到包括铜绿假单胞菌在内的革兰阴性菌和某些革兰阳性菌如金葡球菌及非典型性病原体,且半衰期有所延长。
第二代喹诺酮主要用于治疗组织病如复杂性膀胱炎、肾盂肾炎、性传播疾病、特定类型肺炎、皮肤感染和尿路感染等。
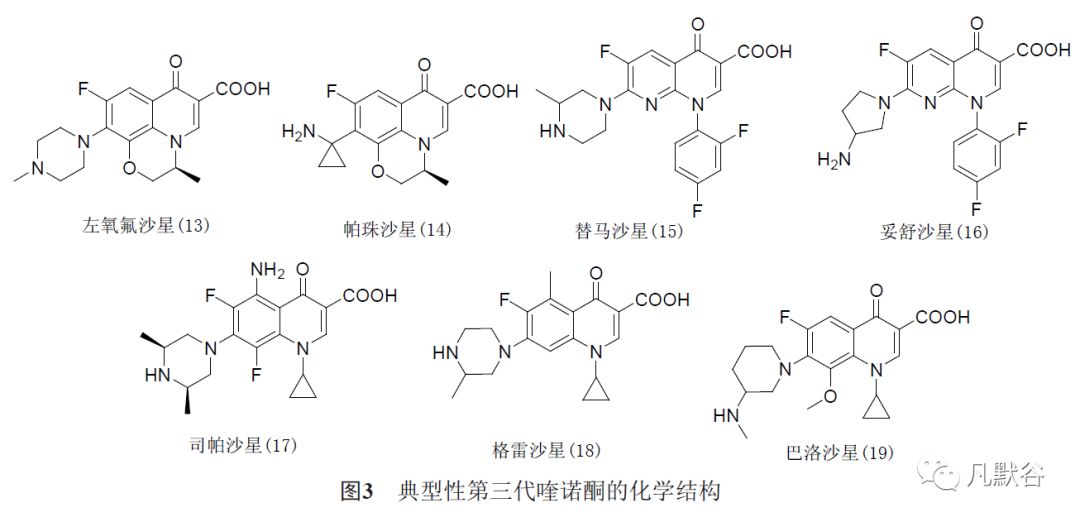
第三代喹诺酮(见图3)包括左氧氟沙星(13)、帕珠沙星(14)、替马沙星(15)、妥舒沙星(16)、司帕沙星(17)、格雷沙星(18)和巴洛沙星(19)等。
与第二代喹诺酮相比,第三代喹诺酮的抗菌谱进一步得以拓展。
总体而言,第三代喹诺酮对包括铜绿假单胞菌在内的革兰阴性菌、阳性菌和厌氧菌具有广谱抗菌活性,且半衰期较长。
第四代喹诺酮(见图4)主要包括普卢利沙星(20)、曲伐沙星(21)、阿拉曲沙星(22)、德拉沙星(23)、克林沙星(24)、贝西沙星(25)、西他沙星(26)、非那沙星(27)、加替沙星(28)、吉米沙星(29)和莫西沙星(30)等。
第四代喹诺酮对革兰阳性菌尤其是肺炎链球菌和肠杆菌科的活性极高,对非典型性细菌和厌氧菌也有潜在的活性。
此类喹诺酮的半衰期长,且可同时作用于脱氧核糖核酸(DNA)促旋酶和拓扑异构酶IV,不易产生耐药性。
除上述喹诺酮外,目前还有若干氟喹诺酮(见图5)如左那氟沙星(31)、奈诺沙星(非氟喹诺酮, 32)和扎博沙星(zabofloxacin, 33)等正处于临床研究后期阶段,结果值得期待。
2
喹诺酮抗菌构-效关系
喹诺酮的抗菌活性是各个位点取代基共同作用的结果(见图6),只有合理的搭配各个位点的取代基才有可能获得抗菌谱更广、活性更高、毒副作用更低和药代动力学性质更加优秀的新型喹诺酮抗菌药。
N-1位取代基与DNA大沟之间有疏水作用,影响喹诺酮的抗菌活性、药代动力学和微生物学性质。
环丙基是目前公认的最佳取代基,而2,4-二氟苯基对厌氧菌有利。
C-2位紧邻DNA促旋酶或拓扑异构酶IV的结合位点,故大取代基会阻止喹诺酮与DNA促旋酶或拓扑异构酶IV结合,导致活性降低。
目前的研究结果表明,仅有硫杂小环如普卢利沙星(20)中的四元杂环可替代氢。
C-3-羧酸和C-4位羰基结构单元是DNA促旋酶的结合位点,对喹诺酮的抗菌活性至关重要,故对该位点进行修饰往往会导致活性的降低甚至消失。
C-5位取代基可能会改变喹诺酮母核的平面构型,对抗革兰阳性菌活性有一定的影响。
研究显示,向C-5位引入氨基、羟基和甲基能够显著地提高喹诺酮抗革兰阳性菌和刚地弓形虫活性。
甲基能提高喹诺酮抗革兰阳性菌活性,但并不能改善抗革兰阴性菌活性,而卤素和甲氧基的引入对抗菌活性不利。
C-6位的氟原子可以增强喹诺酮对DNA促旋酶的抑制作用和提高对细胞膜的渗透性,进而大幅提高抗菌活性。
C-7位取代基被认为可直接与DNA促旋酶或拓扑异构酶IV相互作用,且含氮五元或六元碱性杂环最优。
最常见的基团为氨基吡咯烷或哌嗪基,其中,氨基吡咯烷基可提高抗革兰阳性菌活性,而哌嗪基可增强抗假单胞菌活性。
进一步研究发现,对氨基吡咯烷或哌嗪基进行烷基化亦可提高抗革兰阳性菌活性。
值得一提的是,向喹诺酮的C-7位引入大取代基不仅可提高抗厌氧菌活性,而且使喹诺酮不易被外排运转蛋白排出,降低野生菌株产生耐药的几率。
基于此,向喹诺酮的C-7位杂合其它药效团无疑是不错的选择。
C-8位的取代基与C-5位取代基相似,会影响分子的立体构型,故对该位点的修饰可能会影响喹诺酮分子对靶点的亲和力。
向C-8位引入卤素氟或氯可改善抗厌氧菌活性,而引入卤素、甲基和甲氧基可增强这类化合物对革兰阳性球菌甚至耐早期氟喹诺酮致病菌的活性。
有趣的是,C-8位取代的喹诺酮对DNA旋转酶A亚单位(GyrA)突变的大肠埃希菌和分枝杆菌属的杀菌活性有所增强。
N-1和C-8之间用杂环连接如氧氟沙星和左氧氟沙星或C-8位无取代如环丙沙星的喹诺酮对拓扑异构酶IV具有高活性,故在临床上很少用于抑制DNA促旋酶。
3
作用机制
喹诺酮类抗菌药通过与细菌DNA促旋酶(水解三磷酸腺苷所必需的拓扑异构酶II)或拓扑异构酶IV发生交互作用形成三元复合物,诱导DNA促旋酶和拓扑异构酶IV发生构型改变,进而导致DNA降解及菌体死亡。
喹诺酮对革兰阳性菌的主要作用靶点为拓扑异构酶IV,而对革兰阳性菌的主要作用靶点则为DNA促旋酶。
细菌的促旋酶与哺乳动物差异明显,而喹诺酮对二者的选择性相差上千倍,故总体而言,喹诺酮的安全性良好。
4
最新研究进展
含芳基的1,2,3-三氮唑-喹诺酮杂合体(见图7)34~36对所测革兰阳性菌(金葡球菌和酿脓链球菌)的最小抑制浓度(MIC)为0.2~0.5 μg/mL,优于母药环丙沙星、诺氟沙星和吡哌酸。
不仅如此,三者对革兰阴性菌伤寒沙门氏杆菌和大肠埃希菌也具有良好的活性(MIC: 0.2~0.5 μg/mL),且三者的吸收、分布、代谢、排泄和毒性(ADMET)在可接受水平,值得深入研究。
克林沙星-1,2,4-三氮唑杂合体对所测细菌及真菌均具有潜在的活性,其中,杂合体37 (WY-1, MIC:0.25~1 μg/mL)的抗微生物活性优于母药克林沙星。
向喹诺酮的N-1位引入三氮唑片段可增强抗耐药菌活性,而三氮唑本身就是抗真菌药物的药效团,故三氮唑的引入也可能提高喹诺酮的抗真菌活性。
6-甲基喹诺酮-1,2,4-三氮唑杂合体38不仅对所测的所有革兰阳性菌和阴性菌均显示出良好的活性,而且对黑曲霉、酵母菌和白念珠菌等真菌(MIC: 0.5~4 μg/mL)也显示出潜在的活性,提示该杂合体的作用靶点可能异于传统的喹诺酮。
在三氮唑C- 3 位含有哌嗪基的1 , 2 , 4 - 三氮唑-5(4H)-酮/硫酮-环丙沙星杂合体39和40对所测的所有革兰阳性菌和阴性菌均显示出极为优秀的活性,MIC<0.24 μg/mL,远优于对照药氨苄青霉素(MIC: 3.9~250 μg/mL)。
进一步研究表明,对1,2,4-三氮唑-5(4H)-硫酮-环丙沙星杂合体而言,1,2,4-三氮唑-5(4H)-硫酮片段对抗菌包括耐药菌活性而言至关重要;1,2,4-三氮唑-5(4H)-硫酮的C-3位的苯基尤其是含有供电子基的苯基取代基是这类杂合体具有优秀抗菌活性所必需的官能团;N-4位为短的烷基取代基如乙基时对活性有利。
其中,代表物41对药敏型和耐药型革兰阳性菌和阴性菌的活性均衡,MIC低至0.01~1.32 μg/mL。
而将萘啶酮嵌入至1,2,4-三氮唑-5(4H)-硫酮的C-3位所得的杂合体42也具有良好的抗菌活性,MIC为<1.0~9.7 μg/mL,优于对照药氨苄青霉素(MIC: 10~>128 μg/mL)。
渗透性的改善、新的作用机制和非外排泵底物可能是这类杂合体具有如此高抗菌活性的重要原因。
3-烷氧亚胺基-4-(环丙胺基)甲基吡咯烷基(见图8)43和44 (MIC: <0.008~8 μg/mL)对包括耐喹诺酮MRSA(耐甲氧西林金葡球菌)、MRSE(耐甲氧西林表葡球菌)、屎肠球菌和粪肠球菌等革兰阳性菌具有良好的抗菌活性,研究显示这类化合物的脂溶性对抗菌活性影响不大。
对含有3-烷氧亚胺基哌啶基/氮杂环丁烷基的喹诺酮/萘啶酮的抗菌活性评价结果表明,IMB-070593(45)的体外抗菌活性优于左氧氟沙星和吉米沙星,体内抗革兰阳性菌(包括MRSA和MRSE)活性与吉米沙星和莫西沙星相当。
不仅如此,临床前研究结果显示,IMB-070593的光毒性、肝毒性和心脏毒性极低,极具进一步研究前景。
初步SAR研究结果表明,喹诺酮母核优于萘啶酮(46),且第二个烷氧亚胺基(47)的引入对活性不利。
含烷氧亚胺基的喹诺酮48~50对所测的包括MRSA、MRSE和MSSA(甲氧西林敏感型金葡球菌)在内的所有革兰阳性菌具有极高的活性,MIC为<0.008~0.5 μg/mL。
IMB-070593的位置异构体51对MSSA、MRSA和MRSE的活性是对照药的16~128、2~32和4~8倍,而扎博沙星衍生物52和吉米沙星衍生物DW286 (53)具有良好的抗菌活性和药代动力学性质。
N-1位为2-氟环丙基的烷氧亚胺基的喹诺酮53和54(MIC: <0.008~2 μg/mL)不仅对所测的16株包括MRSA和MRSE在内的革兰阳性菌显示出良好的活性,而且具有良好的体内活性(ED50: 11.43~26.04 mg/kg)。
3-芳基呋喃-2(5H)-酮-环丙沙星杂合体(见图9)56对耐多药大肠埃希菌的MIC50为0.11 μg/mL,活性是母药环丙沙星的51倍。
进一步研究显示,该杂合体是潜在的多靶点抑制剂,对DNA促旋酶和酪氨酸转运核糖核酸(tRNA)合成酶(TyrRS)的半抑制浓度(IC50)分别为1.15和0.12 μM。
7-(3-烷胺基)氮杂环丁基氟喹诺酮由于向氮上引入了烷基,脂溶性和渗透性有所增强、口服吸收有所改善。
其中,WQ-3810 (57)对耐喹诺酮致病菌的MIC为0.01~0.2 μg/mL,对革兰阴性菌的活性优于左氧氟沙星。
进一步研究显示,该化合物具有良好的药代动力学性质,且发生副作用的几率较低,值得深入研究。
2-氨基噻唑-喹诺酮58对伤寒沙门氏杆菌和MRSA的MIC分别为1和8 μg/mL。
进一步研究发现,杂合体58具有膜活性,能快速杀灭被测细菌且能有效的阻止耐药性的产生。
分子对接试验表明,该杂合体可通过氢键和疏水作用与拓扑异构酶IVe-DNA复合物结合,且可插入小牛胸腺DNA形成稳定的超分子复合物进而抑制DNA的复制发挥生物活性。
苯并噻唑-4-噻唑烷酮与环丙沙星或诺氟沙星形成的杂合体对革兰阳性菌和阴性菌均具有良好的活性。
SAR显示,环丙沙星杂合体的抗革兰阴性菌活性优于相应的诺氟沙星杂合体,而后者的抗革兰阳性菌活性则优于前者;苯并噻唑上的取代基对活性影响显著。
其中,代表物59 (MIC: 2.0 μg/mL)对大肠埃希菌和铜绿假单胞菌的活性是环丙沙星(MIC: 6.25μg/mL)的3倍。
噁唑烷酮-氟喹诺酮杂合体对革兰阳性菌和阴性菌(包括耐氟喹诺酮和耐利奈唑胺临床分离株)均显示出良好的活性,尤其是噁唑烷酮-环丙沙星杂合体60(MIC: 0.125~4 μg/mL)对所测包括耐氟喹诺酮和/或耐万古霉素和/或耐利奈唑胺在内的所有菌株均具有良好的活性。
显然,这类杂合体可能在对付耐药、耐多药和完全耐药细菌领域大有作为。苯磺酰胺-喹诺酮衍生物也具有潜在的抗菌活性,其中苯环上带有两个甲氧基(61和62)或两个氯(63和64)对活性有利。
代表物61对所测的金葡球菌、枯草芽胞杆菌、大肠埃希菌和铜绿假单胞菌的MIC均为0.470 μmol/L,优于环丙沙星(MIC: 0.758 μmol/L)。
含噻吩的喹诺酮65对革兰阳性菌和阴性菌显示出优秀的体外活性,而1,8-萘啶酮66对包括耐药菌在内的革兰阳性菌和阴性菌具有良好的体外活性,但对临床分离耐多药金葡球菌活性较弱。
尽管如此,1,8-萘啶酮66对表葡球菌和粪肠球菌(MIC: 0.125 μg/mL)的活性是环丙沙星(MIC: 0.5 μg/mL)的4倍,仍具有进一步研究的价值。
苯并呋咱-洛美沙星杂合体(见图10)67(抑菌MIC: 0.97~3.1 μg/mL, 杀菌MIC: 1.9~12.5 μg/mL)的活性是母药洛美沙星的8倍,而化合物68(MIC: 2 μg/mL)对金葡球菌的活性是洛美沙星(MIC: 4 μg/mL)的2倍。
化合物69(MIC: 0.25 μg/mL)对大肠埃希菌和的活性也是母药洛美沙星(MIC: 2 μg/mL)的8倍,对铜绿假单胞菌(MIC: 2 μg/mL)的活性也优于洛美沙星(MIC: 8 μg/mL)。
黄酮类具有潜在的抗耐多药菌活性,故有必要将其与氟喹诺酮杂合以拓展抗菌谱。
黄酮-环丙沙星杂合体70(见图11)对大肠埃希菌、枯草芽胞杆菌、金葡球菌和白念珠菌具有良好的活性,MIC分别为0.71, 0.062, 0.29和0.14 μg/mL。进一步研究表明,这类杂合体可抑制DNA促旋酶和外排泵。
分子对接试验表明,黄酮片段不仅能够增强杂合体与作用靶点的结合作用,而且不会干扰喹诺酮的作用机制。
基于此,将抗生素与外排泵抑制剂共价杂合可能能增强对耐药菌的活性。靛红-环丙沙星杂合体71具有良好的体内外抗菌活性,其对大肠埃希菌的MIC为0.2~15.7 μg/mL。
在感染大肠埃希菌的小鼠模型中,该杂合体(半数效应浓度/EC50: 0.62 mg/kg)的疗效优于母药环丙沙星(EC50: 1.25 mg/kg),值得深入研究。
将甲硝唑引入氟喹诺酮可能会进一步拓展抗菌谱和抗菌活性,如甲硝唑-克林沙星杂合体72(MIC: 0.25 μg/mL)对变形杆菌、铜绿假单胞菌、MRSA、枯草芽孢杆菌和藤黄微球菌的活性是母药克林沙星(MIC: 1 μg/mL)的4倍。
吡嗪酰胺-环丙沙星杂合体73(MIC: 74.6和149.3μmol/L)对金葡球菌和化脓性链球菌的活性明显优于对照药诺氟沙星(MIC: 3914.3和1957.2 μmol/L)和环丙沙星(MIC: 3772.4和3772.4 μmol/L)。
C-7位哌嗪连接的双氟喹诺酮对所测菌株具有良好的抗菌活性,其中,代表物环丙沙星-吡哌酸杂合体74 (MIC: <0.03~2μg/mL)对药敏型和耐药型金葡球菌均显示出优秀的活性,可作为先导物进一步优化。
红霉素可用于治疗各种细菌感染,将其与喹诺酮杂合可能会获得具有双重作用机制的候选物。
红霉素-环丙沙星杂合体75对所测所有致病菌的MIC为0.125~4 μg/mL,对包括耐药菌在内的大多数致病菌的活性是对照药阿奇霉素的8倍,值得深入研究。
妥布霉素-环丙沙星杂合体(见图12)76和妥布霉素-莫西沙星杂合体77可通过自身促进吸收机制使其更易通过渗透性进入细菌内,进而达到杀灭细菌的目的。
SAR表明,妥布霉素的C-5位和环丙沙星哌嗪上的仲胺是最好的连接位点。
这类杂合体的分级抑菌浓度(FIC)指数为0.077~0.139,对野生型铜绿假单胞菌具有协同作用。
新霉素B-环丙沙星杂合体78和79的抗菌活性远优于母药新霉素B,对枯草芽孢杆菌、MRSA和多株耐药大肠埃希菌的MIC分别为1.5和3、3和12及0.75~3和0.75~12 μg/mL。
此外,杂合体78体外抑DNA促旋酶和拓扑异构酶IV活性是母药环丙沙星的15和20倍,值得深入评价。
6-氨基尿嘧啶可特异性地作用于DNA复制所必需的聚合酶IIIC,故将其与氟喹诺酮杂合(如80,见图13)可能得到具有双重作用机制的杂合体。
初步研究结果显示,6-氨基尿嘧啶-喹诺酮杂合体不仅对枯草芽孢杆菌和DNA聚合酶IIIC具有良好的活性,对包括耐药菌在内的各种致病菌也显示出优秀的活性,MIC为0.313~2.5 μg/mL。
而甲氧苄氨嘧啶-环丙沙星杂合体BP-4Q-002(如81)对药敏型和耐环丙沙星致病菌的活性与甲氧苄氨嘧啶、环丙沙星或二者1:1混合物相当或更优,值得进一步研究。
对环丙沙星/诺氟沙星-二价铜离子(Cu2+)螯合物的体外抗革兰阳性菌(金葡球菌和枯草芽孢杆菌)和阴性菌(灵杆菌、大肠埃希菌和铜绿假单胞菌)活性评价结果表明,环丙沙星螯合物(MIC:0.36~2.9 μg/mL)的活性优于相应的诺氟沙星衍生物(MIC: 3.0~4.4 μg/mL)。
其中,代表物82(MIC: 0.6~1.4 μg/mL,见图14)的活性是母药环丙沙星的2.7~6.3倍。而喹诺酮衍生物83和84(IC50: 1.22和2.20 μmol/L)对脲酶具有良好的活性,活性优于母药环丙沙星和左氧氟沙星。
5
结语
经过50余年的发展,氟喹诺酮已成为继头孢菌素之后的第二大类抗感染化疗药物。
然而,随着氟喹诺酮的广泛、长期使用甚至滥用,细菌已对其产生了严重的耐药性。
为克服耐药性,亟需研发新型喹诺酮。氟喹诺酮结构骨架可供修饰的位点较多,其中,C-7位取代基与抗菌谱、抗菌活性、药代动力学性质和安全性等密切相关,被认为是最适合修饰的位点。
事实上,近年来新上市的氟喹诺酮如德拉沙星和处于后期临床评价阶段的候选物如左那氟沙星、奈诺沙星和扎博沙星等均是对C-7位修饰的成果。
特别值得一提的是,向氟喹诺酮的C-7位引入其它药效团所形成的氟喹诺酮杂合体不仅可能具有双重或多重作用机制增强对耐药菌的活性,还具有可拓展抗菌谱、改善药代动力学和减少毒副作用的潜力。
因此,氟喹诺酮杂合体是目前该领域研究的热点。
令人鼓舞的是,多个氟喹诺酮杂合体如利福霉素-氟喹诺酮杂合体CBR-2092和β-内酰胺-氟喹诺酮杂合体Ro-23-9424等目前正处于临床评价阶段,结果值得期待。
本文综述了近年来氟喹诺酮类化合物尤其是氟喹诺酮杂合体在抗菌领域的最新研究进展,并归纳了此类化合物的SAR,以启迪科学家设计活性更高的候选物。