1、肠道菌群与先天免疫系统互作
物理障碍、先天免疫细胞和分子构成了先天免疫系统,这是抵御病原体感染的第一道防线。在肠道内,嗜中性粒细胞和巨噬细胞通过模式识别受体(PRRs)识别和响应微生物群落的异常变化以调控肠道菌群。PRRs识别微生物相关分子模式(MAMP),主要包括肽聚糖,鞭毛蛋白,脂多糖(LPS)和微生物的核酸结构。一些通过营养发酵的细菌代谢产物也被PRRs识别,如丁酸盐。
PRRs由Toll样受体(TLR),NOD样受体(NLR),RIG-I样受体(RLR),C型凝集素受体(CLR)。PRRs是先天性免疫系统中不可或缺的成分,研究报道表明,PRRs同时参与适应性免疫反应。本文主要关注2个重要的PRRs亚家族TLR和NLR,这是了解细菌-宿主交互作用的非常典型的例子(图1)。
2、肠道细菌与粘膜屏障之间的互作
肠道粘膜是一个动态界面,包含上皮单层,它在机构上将肠道相关淋巴组织与共生菌群落分隔。在功能上,肠道粘膜屏障是通过粘液层,肠细胞和紧密连接的协作共同防御病原体侵入的第一道自然防线。
消化道中的胃酸和蛋白质水解酶消化了进入肠道的大部分病原体。但是,仍然存在一些顽固性细菌,如幽门螺杆菌,它们通过改变周围环境的pH值,在酸性环境中存活。因此,上皮细胞间形成的紧密连接是防止病原体侵入的直接屏障。然而,一些病原体,例如许多肠杆菌科细菌,可以破坏肠上皮完整性和减少粘液分泌,如鼠伤寒沙门氏菌可引起腹泻,伤寒和胃肠炎。
此外,粘膜屏障和肠道病原体之间的相互作用需要共生细菌的参与,这不仅有助于抵御病原体,而且保持粘膜完整性和屏障功能。结肠的内粘液层将菌群与上皮细胞隔离的能力取决于定植的菌群向宿主上皮细胞传递信号。
无菌(GF)小鼠的若干实验证实了共生细菌的必要性。据报道,肠道接触细菌是刺激粘液合成的充分途径。同时,粘液的成熟度和丰度也依赖于肠道细菌。类似的研究发现,在GF小鼠中,即使粘液结构与常规小鼠的相似,小肠粘液也会附着在上皮上,并且结肠内部粘液层可被细菌渗透。此外,GF小鼠的Muc2 O-聚糖水平较低,这可能与负责O-聚糖延伸的糖基转移酶降低相关。有趣的是,考虑到聚糖是细菌的附着位点和能量来源,Muc2O-糖基化的减少反过来会阻碍细菌定植。
另外,在缺乏共生菌的情况下,肠上皮细胞(IECs)和紧密连接受损。在GF小鼠中,紧密连接蛋白即occludin和zos-1的表达减少。与常规小鼠相比,刷状缘上的肠上皮细胞的排列更不规则。但是,在乳酸杆菌定居后,微绒毛的排列组织良好。益生菌对肠道屏障的修复功能和益处也在Akk菌中得到证实,其潜在机制可能与调节肠粘液的厚度以维持肠屏障的完整性有关。
3、TLRs与菌群互作
包括由上皮细胞表达的TLR在内的模式识别受体(PRRs),可以识别共生细菌的MAMPs并调节共生菌和宿主之间的互作。宿主的微生物群组成受到TLRs及其接头蛋白状态的影响。TLR信号传导缺陷和内源性微生物群紊乱引起的异常免疫反应是造成IBD患者炎症和组织损伤持续存在的主要因素之一。
迄今为止,已经确定了13种不同的TLR。据报道,在抗生素处理的小鼠中TLR表达会呈现不同的变化,也表明TLRs之间的功能差异。
因此,上述结果意味着在TLR上存在精确的MAMP识别机制以确保对细菌的准确反应。同时,肠道病原体和共生细菌的组成和活性也受TLR信号调节。最重要的是,在MAMP识别中彼此协作的不同TLR以相对独立的方式与肠道菌相互作用。
4、NLRs与菌群互作
NLR位于细胞质中。NOD样受体对于识别细菌以调控健康的肠道微环境必不可少。多项研究表明,缺乏NOD1,NOD2或NLPR6的小鼠的细菌组成发生改变。
在NLRs中,NOD1和NOD2是最先鉴定的,在病原体识别中发挥重要作用。相反,肠道菌群组成的改变和易位可以调节NOD1和NOD2的信号传导。在粘膜免疫系统中,NOD1和NOD2与配体结合,激活与受体相互作用蛋白家族2和NF-κB通路。
据报道,NOD1识别革兰氏阴性菌的d-谷氨酰内消旋-二氨基,NOD2识别胞壁酰二肽(肽聚糖的代谢物)。非侵入性幽门螺杆菌感染依赖于NOD2信号传导。研究表明,NOD1对于防止非侵袭性艰难梭菌和Spi1缺陷型沙门氏菌突变体感染是必不可少的。在缺乏NOD2的情况下,拟杆菌(Bacteroidesvulgatus)增加、炎症反应加剧、杯状细胞功能障碍和炎性基因异常表达。
由于许多PRRs在免疫应答中发挥复杂、且矛盾的作用,因此有必要探索大多数PPRs在不同微环境下的基本识别机制,以及他们之间如何相互作用将共生菌从有害细菌中区分开来,以维持肠道动态平衡。总之,大多数PPR缺陷导致细菌群体组成异常。健康的先天免疫系统有助于肠道菌组成的优化,先天免疫系统的失调可能导致肠道菌群紊乱,可能导致疾病。
5、肠道菌群与适应性免疫系统的互作
通常,适应性免疫在病原体感染后几天开始,并产生与先天免疫系统配合的细胞因子和特异性抗体,以防止随后的病原体入侵。T细胞和B细胞是参与适应性免疫应答的2种主要免疫细胞。在适应性免疫应答期间,会进一步诱导记忆性T和B细胞产生二次免疫应答。
在肠道中,病原体和共生菌都是诱导适应性免疫应答的有效刺激物。相反,适应性免疫系统也是抵抗病原体入侵和调节共生菌群的有力武器。适应性免疫系统的损害可能导致肠道菌群异常和失衡。本章节重点讨论菌群变化和适应性免疫反应的双向效应,包括T细胞分化和分泌性免疫球蛋白A(SIgA)的分泌。
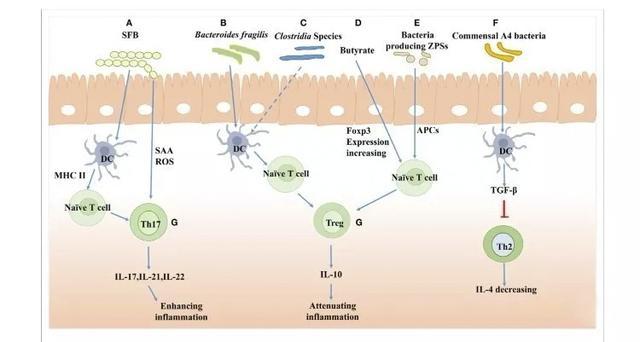
细菌和Th1,Th2 , Th17, Treg的细胞分化和细胞毒性淋巴细胞是通过细胞因子产生来调节适应性免疫应答的主要效应T细胞。Th17细胞产生促炎细胞因子,如IL-17,IL-21和IL-22,以增强炎症。Treg细胞分泌抗炎细胞因子IL-10以减轻炎症。Th17和Treg细胞分化之间的动态平衡是通过调节细胞因子如IL-6,IL-21和IL-2介导的。
在肠道内,一些细菌或某些已知的细菌混合物可影响T细胞的生成和分化。最近的研究表明SFB诱导Th17细胞在固有层的局部分化。几个团队也研究了梭菌定殖对T细胞分化的影响,发现梭状芽胞杆菌(Clostridia)可诱导Treg细胞的扩增以抑制结肠炎小鼠的炎症反应。此外,细菌产物如多糖也可影响T细胞分化。来自脆弱类杆菌的多糖A(PSA)促进Treg细胞分泌,抑制Th17活性以增强其肠道定植。
此外,T细胞的缺乏也会引起菌群的改变。据报道,Dishevelled1(Dvl-1)是Wnt/β-catenin途径的重要蛋白质,其控制T细胞祖细胞的增殖并调节T细胞发育和Treg细胞活化。在Dvl-1敲除小鼠中,通过促进机会性病原体生长,例如螺杆菌(Helicobactermastomyrinus)和抑制共生菌生来改变肠道细菌组成。
基于上述研究,可以推测调节T细胞分化是肠道共生菌在肠道内维持自身生存的机制。同时,T细胞的正常发育和分化对微生物群落的塑造也发挥作用,并且是维持肠道微生物体内平衡所需的。(图2)
6、肠道菌与SIgA分泌的关系
SIgA是肠道粘膜中最丰富的抗体。它由IgA二聚体和分泌成分(聚合型免疫球蛋白受体衍生多肽)组成,这个分泌组分由肠细胞分泌以稳定SIgA的结构并将SIgA固定在粘液上。PP和MLN的淋巴结是SIgA的主要分泌部位。一般来说,大多数SIgA的产生依赖于T细胞。
细菌抗原刺激时,PP中的IgA+B细胞通过淋巴细胞归巢转移至肠基质层以产生IgA并将其分泌至肠腔中。SIgA可以聚集潜在的和侵入性病原体,通过肠蠕动和粘膜纤毛运动来促进病原体的清除。然而,SIgA将共生菌与有害菌区分的机制仍不清楚,需要更多的研究来探索潜在的途径。
目前,一项深入研究发现IgA介导的肠内稳态和细菌组成的改变是由肠道T细胞中的MyD88信号引导的。此外,限制肠道共生菌的生长和炎症反应并维持其多样性可能是IgA调节细菌稳态的两种潜在机制。
原文出处:Nutrients mediateintestinal bacteria-mucosal immune crosstalk(2018-01,Frontiers in Immunology)