近日,北京生命科学研究所/清华大学生物医学交叉研究院陈婷课题组和北京医院常建民教授团队在Nature上发表文章 “Anatomically Distinct Fibroblast Subsets Determine Skin Autoimmune Patterns”,通过单细胞测序将白癜风致病机理的研究重点集中到成纤维细胞这一细胞类型上,阐明了IFNγ引起成纤维细胞响应,招募自身免疫CD8+ T细胞攻击黑色素细胞,促进皮肤白斑的病理机制,并解析了白癜风部位特异性和对称性病变的分子机制。对自身免疫病病理研究和治疗方案的开发有重要意义。该研究中部分10x Genoimcs单细胞转录组测序服务由博奥晶典提供。
不同部位差异性成纤维细胞决定皮肤自身免疫模式
Anatomically Distinct Fibroblast Subsets Determine Skin Autoimmune Patterns
【发表时间】 2021年12月
【发表期刊】 Nature
【影响因子】 49.962
【发表单位】 北京生命科学研究所/清华大学生物医学交叉研究院、北京医院
研究背景
皮肤是人体保护自我的重要物理屏障和免疫界面,但皮肤免疫细胞的异常激活可以引起自身免疫疾病。白癜风就是主要的自身免疫疾病之一,全球有0.5%-2%的患者,其中80%在多个身体部位发生双侧对称性病变,被称为非节段型白癜风。白癜风的病理是具有自身免疫活性的 CD8+ T细胞攻击表皮黑色素细胞,造成皮肤脱色斑块。过去研究表明IFNγ参与此过程,但其具体作用的细胞类型和机制仍未知。而对于白癜风对称性病变的原理,有很多理论假说,但仍然没有细胞和分子层面的有力证据。因此,需要从单细胞水平分析理解白癜风致病机理,这对开发新的自身免疫疾病的治疗方案也具有指导性意义。
研究思路
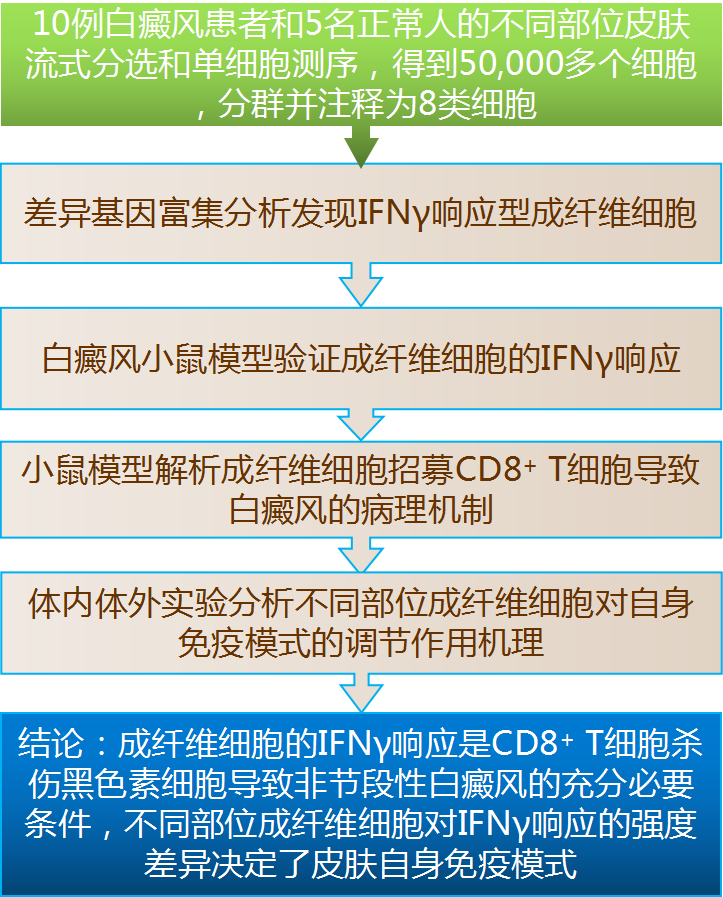
图1. 研究思路。
主要结论
1、单细胞测序揭示白癜风患者皮肤中响应 IFNγ 的细胞类型
图2. 单细胞测序分析白癜风患者细胞类型。
研究团队对10例白癜风患者和5名正常对照的皮肤细胞分选后进行了单细胞转录组测序。结果分析得到50,000多个细胞的表达谱数据,分群并注释为包括角质形成细胞、朗格汉斯细胞、T 细胞、成纤维细胞、黑色素细胞、内皮细胞、肌肉细胞及单核巨噬细胞等8个主要细胞类型(图2)。
图3. 单细胞测序对T细胞的分群分析。
图4. 单细胞测序和染色验证确定白癜风患者IFNγ响应细胞类型。
研究团队对T细胞进行了分群分析,发现白癜风患者中存在更多的杀伤性 T 细胞,而且患者的杀伤性 T 细胞表达更高的IFNG基因(图3,图4e-f)。进一步GO分析发现黑色素细胞和成纤维细胞中富集IFNγ信号通路基因,而荧光染色显示80%的pSTAT1 + 细胞是成纤维细胞。这些数据表明白癜风患者中响应IFNγ信号的主要是成纤维细胞(图4g, h)。
2、皮肤基质细胞的 IFNγ 响应促进白癜风的发生
图5. 皮肤基质细胞调节旁泌性IFNγ驱动CD8+ T细胞杀伤作用。
为了从体内实验验证IFNγ响应的细胞类型,研究团队首先建立了一种白癜风小鼠模型。对野生型小鼠进行黑色素瘤细胞注射和调节性T细胞去除后,小鼠出现白癜风表型且病变组织中有CD8+ T细胞浸润。而有意思的是,Ifngr1敲除小鼠经过相同的模型诱导,则没有CD8+ T细胞浸润和白癜风症状,这表明IFNγ信号是 CD8+ T 细胞杀伤表皮黑色素细胞的必要条件(图5a-c)。研究团队通过皮肤移植实验实验发现,在一个完全没有IFN-γ响应的皮肤局部环境中,给予了外来的能响应IFN-γ的皮肤能够介导局部CD8+ T细胞的招募和聚集,从而引起了黑色素细胞的大量损失(图5d-f)。
3、皮肤基质细胞的 IFNγ 响应引起白癜风
那么接收 IFNγ 信号响应的是哪一类细胞呢?研究团队利用Cre-loxP技术在皮肤的主要细胞类型中分别特异性敲除了Ifngr1(图6a),在模型诱导33天后观察黑色素细胞数量和CD8+ T细胞浸润情况,发现只有成纤维细胞敲除Ifngr1可以阻止白癜风发生(图6b)。研究人员还用另外两种白癜风模型鼠验证了该结论。进一步成纤维细胞移植实验证明成纤维细胞表达 Ifngr1是招募CD8+ T细胞的充分条件(图6c)。至此,可以肯定成纤维细胞的IFNγ响应是白癜风进展的充分必要条件。
图6. 真皮成纤维细胞分泌趋化因子调节自体免疫的 CD8+ T 细胞。
4、成纤维细胞表达 CXCL9 / CXCL10 招募 CD8+ T 细胞
成纤维细胞是如何招募CD8+ T细胞的呢?首先研究团队用体外Transwell迁移实验验证成纤维细胞对CD8+ T细胞的迁移作用(图6d)。再对人单细胞转录组测序数据和模型鼠中的成纤维细胞表达谱分析发现28个共同基因,其中有5个趋化因子基因 CCL5,CCL8,CXCL3,CXCL9 和CXCL10(图6e)。用这些趋化因子进行Transwell迁移实验发现其中CXCL9和CXCL10 可以诱导CD8+ T细胞的迁移。免疫荧光实验确定CD3+ T细胞密度与CXCL9 +/CXCL10 +细胞数量正相关,而且80%的CXCL9 +/CXCL10 +细胞是成纤维细胞(图6f, g)。通过shRNA敲低白癜风模型鼠成纤维细胞中的CXCL9和CXCL10能够有效抑制CD8+ T细胞的富集(图6h)。而CXCL9和CXCL10的受体CXCR3也在CD8+ T细胞中高表达。以上的体内和体外实验共同表明 IFNγ 响应型成纤维细胞通过CXCL9/CXCL10-CXCR3互相作用调节CD8+ T细胞富集。
5、不同部位成纤维细胞对 IFNγ 的响应差异决定皮肤自身免疫模式
图7. 不同部位成纤维细胞亚群对 IFNγ 有响应差异。
有研究表明成纤维细胞具有皮肤区域异质性,但其对自体免疫细胞是否有调节作用仍然未知。研究团队通过统计2,265例非节段型白癜风患者不同部位的发病频率,发现其中手背、胸部发病率最高,而手掌和手臂发病率最低(图7a)。体外培养实验发现部位发病率与其成纤维细胞响应IFNγ的程度正相关(图7b)。其中敏感部位成纤维细胞高表达CXCL9 和CXCL10基因(图7c, d)。而白癜风模型鼠的部位特异性表现为背部和腹部白斑,这些部位都有CD8+ T细胞的富集,且部位成纤维细胞中高表达CXCL9 和CXCL10(图7e, f)。研究团队还用Transwell迁移实验和移植实验对不同部位成纤维细胞的响应差异进行了验证(图7g-i)。最后用数学模型和成纤维细胞IFNγ通路敲低实验,描述了部位特异性真皮成纤维细胞招募CD8+ T细胞,杀伤黑色素细胞,扩张病变区域的模式和机理(图7j, k)。
总结
该研究从单细胞转录组测序入手,结合大量体内体外实验,首次详细描述了成纤维细胞与CD8+ T细胞形成的互作系统在自身免疫病中的关键作用。值得关注的是,其他自身免疫疾病也具有部位偏好性和对称性分布特征,而成纤维细胞又在人体组织器官中广泛存在,那么其他组织器官的自身免疫疾病是否也受到这种成纤维细胞与CD8+ T细胞互相作用的调控呢?这还有待更多的深入研究和验证。总之,该研究为理解自身免疫疾病的机理提供了开创性的新思路,对治疗自身免疫疾病具有重要指导意义。
参考文献:
Xu, Z., Chen, D., Hu, Y. et al. Anatomically distinct fibroblast subsets determine skin autoimmune patterns. Nature (2021).https: //doi.org/10.1038/s41586-021-04221-8.
关于博奥晶典单细胞空间测序平台
博奥晶典作为国内第一家引进10x Genomics平台的公司,率先在国内开展上万级通量的单细胞转录组测序服务。目前已经完成了10000多例样品、几百种不同样品类型的服务,覆盖的物种和样品类型包括人和小鼠的肝脏、肺脏、皮肤、心脏、脑、肾脏、血液、卵巢、神经,以及鸡、斑马鱼、猪、水稻、拟南芥、油菜、白菜、橄榄等,是目前国内大规模单细胞测序经验极丰富的公司。
博奥晶典于2019年12月同时获得了单细胞转录组,单细胞ATAC,单细胞免疫组库3个服务产品的官方CSP认证,并于2020年9月获得了空间转录组产品的官方CSP认证,成为目前国内唯一一家同时获得4项10x Genomics平台服务官方认证的公司。
博奥晶典支持单细胞测序文章分别发表在 Nature、Cell、Cancer Discovery、Circulation、Cell Stem Cell、Journal of Hepatology、Cell Research、Nature Immunology、Nature Cell Biology、GUT、Advanced Science 等期刊,应用领域涉及细胞图谱绘制、类器官、生殖发育、干细胞、血管老化、血管异质性、肿瘤异质性、肿瘤免疫治疗、疾病机制研究等。至此,博奥晶典已累计支持客户发表单细胞高分文章69篇,影响因子982分,是目前国内支持发文最多、累计影响因子最高的公司。
■ 博奥晶典目前可开展以下单细胞测序产品和服务:









