药物和靶点再开发
药物再开发 (也称为药物重定位、药物抢救、再收集、再分配或治疗转换)涉及评估已获批/在研药物对未获批/未研究过的新适应症的疗效。大多数再开发的化合物已经在人类身上证明了安全性,有些已经进展到II期或III期试验。
因此理论上,这些药物可以在其他适应症中进行临床试验,与全新药物相比,药物再开发有望以更快的速度、更低的风险和成本获批。
技术要点
从历史上看,药物再开发的机会往往来自于敏锐且偶然的临床观察、“同情用药(compassionate-use programmes)”和超适应症用药处方。
超过1/4的药物和疗法存在超适应症用药情况,这成功激发了人们对识别药物再开发机会的系统性策略的兴趣(图1),大致可分为实验法和计算法:
· 实验法(Experimental approach)包括分子表达谱分析,以确定获批药物和临床试验候选药物的其他罕见病相关靶点,以及对此类化合物库进行表型筛选。其目的是加速进入针对罕见病适应症的临床试验阶段。
· 计算法(Computational approach)包括对临床试验数据、电子病历和/或上市后监测数据的系统回顾性分析,目的是识别可能与其他疾病相关的意外信息,此外还有虚拟筛选和基于相似性的方法。
例如,转化生物信息学可以将网络和系统生物学方法与机器学习相结合,以推断生物分子与临床观察之间的新关系,从而假设蛋白质在疾病中的新功能和新机制。新兴的在线平台有望增加转化生物信息学在发现罕见病新靶点和通路方面的潜力。
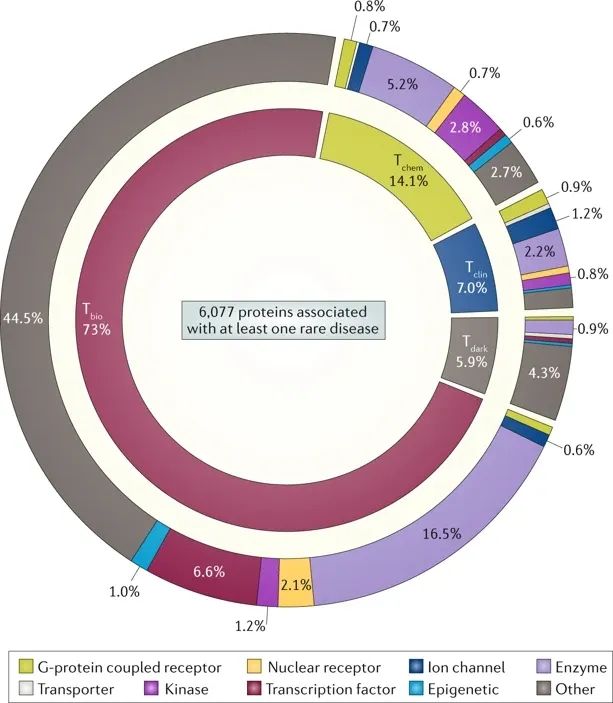
▲图1. 罕见病相关蛋白靶点进展分类
(图源:Nature Reviews Drug Discovery)
Tclin蛋白:与至少一种已获批药物相关联的药物靶点
Tchem蛋白:确认与小分子结合具有高亲和力
Tbio蛋白:对其具有一定的生物学理解水平,但缺乏小分子结合物
Tdark蛋白:对其特征理解非常有限
临床成功和获批
对已获批药物的再开发和适应症扩展往往成功几率较大,西地那非和阿达木单抗就是两个典型的例子:
· 西地那非是一种小分子磷酸二酯酶5抑制剂,于1998年首次获批用于治疗勃起功能障碍,但西地那非一开始是针对心绞痛这一适应症进行开发的。基于其对血管生物学的影响,西地那非后来也被再开发用于治疗一种罕见病——肺动脉高压,并于2005年获批。
· 阿达木单抗是一种以关键炎性细胞因子——肿瘤坏死因子(TNF)为靶点的单抗,于2002年首次获批用于治疗类风湿性关节炎。此后,阿达木单抗又进一步获批用于治疗其他几种炎症疾病,其中不乏一些罕见病,包括2008年获批用于治疗多关节型幼年特发性关节炎,以及2014年获批用于治疗非传染性中间型葡萄膜炎、后葡萄膜炎和全葡萄膜炎。
另一类则是在研药物的再开发。以罕见病为重点的倡议计划包括国际罕见病研究联盟(International Rare Diseases Research Consortium , IRDiRC)和欧盟的E-Rare。
· 2016年,一份欧洲研究区域网络(European Research Area Networks)建议书强调了再开发的迫切性。IRDiRC已经建立了一套初步报告来识别现有化合物在罕见病中的再开发机会,该组织2027年的目标是开发1000种新的罕见病疗法,而再开发是实现这一目标的关键策略。
支持各类疾病药物再开发的计划包括美国国立卫生研究院(NIH)-美国国家转化科学促进中心(US National Center for Advancing Translational Sciences, NCATS)的新治疗用途(NTU)计划和缩小干预发展差距(Bridging Interventional Development Gaps, BrIDGs)计划,以及英国医学研究委员会(Medical Research Council, MRC)和阿斯利康之间的合作计划,这两个计划都涉及原本会被制药公司中途放弃的临床阶段化合物。
虽然到目前为止这些项目中已经进展到临床试验阶段的大多数化合物是针对常见疾病的,但也有很大的潜力用于罕见病的再开发。
· 通过英国医学研究委员会-阿斯利康计划,正在进行一项II期试验评估11β-羟基类固醇脱氢酶1型抑制剂AZD4017对特发性颅内高压的疗效。
· 欧盟委员会专家组European Commission Expert Group on Safe and Timely Access to Medicine for Patients(STAMP)最近公布了一份关于支持非营利组织药物再开发的框架草案。
优势和局限性
药物和靶点再开发使学术机构和患者权益组织有机会参与已获批/临床在研药物的转化研究。公营和私营部门已开始采取主动措施,允许对已获批/在研药物进行筛选,以优化用于罕见病研究的产品选择。
· NCATS临床前创新部门(Division of Preclinical Innovation)还专门开发了NCATS药物集合(Pharmaceutical Collection),其中包括获FDA批准上市的约2500种化合物和批准用于人类临床研究的1000种化合物。
· 美国麻省理工学院(MIT)和哈佛大学-博德研究所(Broad Institute)的共享药物再开发中心筛选库(Repurposing Hub Screening Library),涵盖约6000种化合物的综合注释,包括约2300种已获批药物和约1600种临床在研药物。
▲图源:Broad Institute
然而,再开发并不能解决药物开发面临的所有挑战:
· 首先,尽管由于安全性数据的可及性和对其临床疗效的更好理解,与典型的试验药物相比,再开发的候选药物可能有更大的成功几率和更低的开发成本,但仍需要进行临床试验来证明对新适应症的有效性,并且这些试验可能需要大量进一步的投资。
· 第二,虽然再开发的候选药物的安全性数据可由原始适应症获得,但当新适应症(例如,合并症)或治疗方案(例如,长期与短期)存在一系列不同特殊背景时,药物的安全性特征可能会显著改变。因此,应当仔细评估新适应症中再开发药物/靶点的临床安全性。
· 第三,是否拥有知识产权可能会延迟获得对化合物进行临床评估的权益,并降低公司对药物再开发的投资动力。
为了解决上述挑战,罕见病界——包括学术机构、制药行业、患者权益组织、基金会、支付方以及政府监管和研究机构,必须相互协作,共同参与讨论面临的各类挑战,诸如从电子病历中获取数据和制定患者报告的临床结果等问题。开发一个用于罕见病治疗的再开发平台需要改变“某项药物临床试验只针对单一疾病”的传统策略。


