美国时间2020年1月23日,FDA宣布批准全球首个EZH2抑制剂Tazemetostat重磅上市,批准的适应症为不适用于手术切除的转移性或晚期的上皮样肉瘤(ES)。EZH2靶点是近年表观遗传抗肿瘤领域研究的热门靶点,作为专注于该领域研究的Epizyme公司,凭借Tazemetostat在罕见性上皮样肉瘤上的临床突破,享受了加速批准和优先审评的快速通道,率先获得了EZH2新型靶点药物的上市。
上皮样肉瘤(ES)概况
上皮样肉瘤(Epithelioid sarcoma,ES)是一种极为罕见的软组织肉瘤(soft tissue sarcoma,STS),通常发生在青年和少年,累及手、四肢等皮下组织,诊断之后的中位生存期为30个月,尤其是复发或转移的患者中,ES更具有威胁性,病人生存期通常少于1年。90%以上的ES患者会发生基因INI1(SWI/SNF的一个亚基,亦称SMARCB1)缺失,且成为ES的典型诊断特点。当前使用的传统化疗手段,在ES上尤其是转移性ES并未较好的活性,且毒副作用大、病人生活质量较差。
美国癌症协会预计美国2019年大约有12750例新发STS病例(包括成年人和儿童),约5270例将会死于STS。当前的治疗手段主要有手术治疗、放疗、化疗和靶向治疗。其中靶向治疗作为近年新型的治疗药物,具备靶向性、毒副作用小的特点,是未来STS治疗最具前景的药物治疗方式,如帕唑帕尼,一种VEGFR抑制剂。
表1 当前治疗软组织肉瘤(STS)主要手段
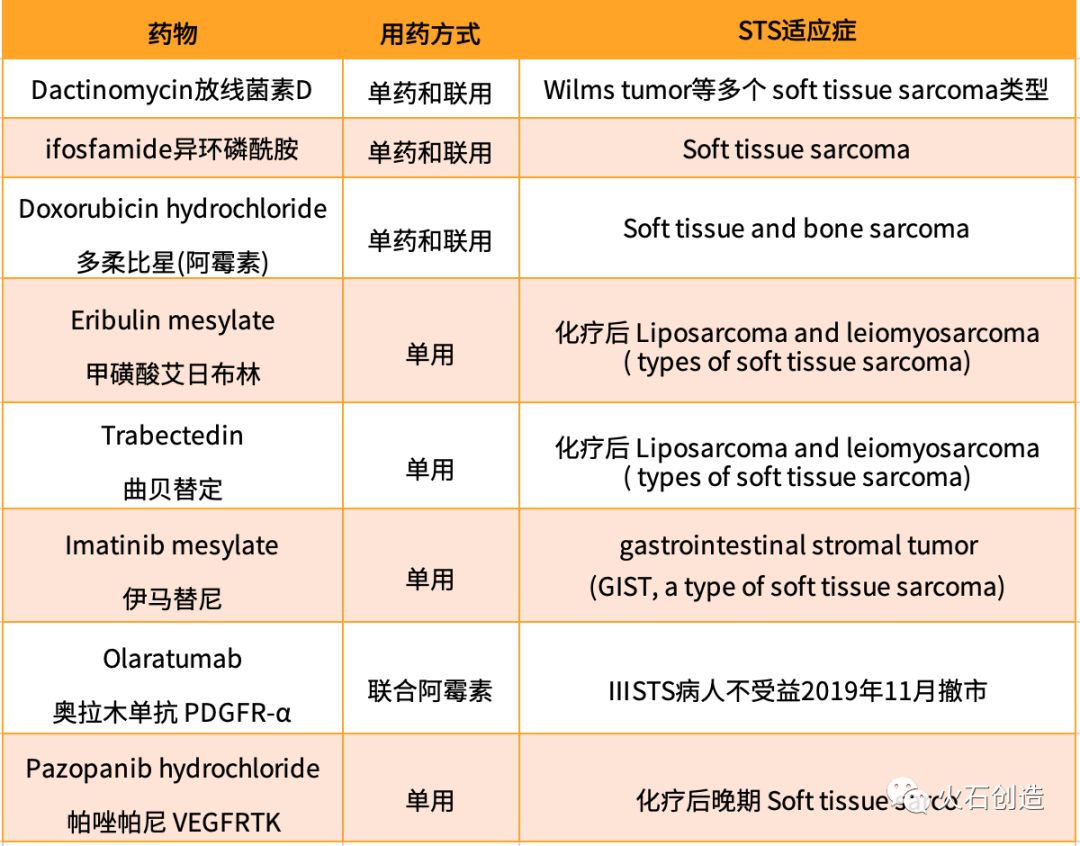
数据来源:FDA官网
Tazemetostat被批准的依据
此次FDA批准Tazemetostat主要基于一项名为EZH-202的国际多中心 、单臂、临床II期试验结果(NCT02601950),入组标准之一是基因INI1缺失。2019年ASCO大会上,Epizyme公布了截至2018年12月的临床数据,在62例初治和复发的患者中,9例患者出现响应,客观响应率(ORR) 为15%;16例患者疾病得到控制,疾病控制率(DCR)为26%,中位总生存期为82.4周。据悉,在初次治疗的ES患者,ORR为25%;患者中位响应时间为41.1周;DCR为42%;在复发和难治性的患者中,DCR达到16%。
表2 Epizyme公布截至2018年12月的临床试验数据
单纯看临床数据,Tazemetostat并未达到大家的期待,但鉴于ES是一种极为罕见疾病,当前无更有效的手段,此次试验是至今开展的最大的具备治疗希望的ES临床试验,证实了有前景的分子靶向单药治疗活性,且安全性和耐受性良好,治疗突发不良事件(TEAEs)主要是1级和2级,仅有13%的病人有3级或以上的治疗相关的TEAEs。
基于这些临床获益和安全性及未满足的临床需求,Tazemetostat获得了FDA肿瘤药物咨询委员会(the Oncologic Drug Advisory Committee)的11票全票通过。此次FDA批准其上市,让更多ES患者能够接受到更好的靶向治疗,也让内科医生的用药储备库中多了一种全新的选择。
图1 Tazemetostat结构式
为支持Tazemetostat是前线治疗ES的完全批准,Epizyme已经启动一项全球III期确证性临床试验,目标是一线治疗ES患者, Tazemetostat联合Doxorubicin对比Placebo联合Doxorubicin的1:1随机对照试验,大约招募150名患者。 Doxorubicin是一种治疗软组织肉瘤(STS)常用的化疗药物,与Tazemetostat的联用有望进一步提高临床获益率。
随着国家临床急需境外新药审评审批政策的落地,预计Tazemetostat 将很快通过专门快速通道进入中国市场,将会是中国ES患者的利好消息。
Tazemetostat作用机制
在正常细胞内,SWI/SNF复合物对PRC2复合物起到抑制作用,促进PRC2(含有EHZ2亚基)靶基因的表达,有利于细胞的分化,当SWI/SNF复合物当中的关键亚基发生突变或缺失时(如ES中INI1缺失),导致PRC2活性增强,其中的催化亚基EZH2会催化H3K27的三甲基化,造成组蛋白和DNA紧密结合,很多抑癌基因的表达受到抑制,而hedgehog、MYC等信号通路基因等上调,促使细胞增殖,形成肿瘤。
当Tazemetostat特异性作用于靶点EZH2时,因INI1缺失造成的EZH2活性的增强又受到了逆转抑制,最终染色质的“捆绑和束缚”得到释放,基因得以正常表达。
图1 azemetostat 作用机制
Tazemetostat体外细胞增殖试验表明 [3] ,INI1缺失的细胞中,IC50值减小了约100倍,由此可见,INI1缺失和Tazemetostat的协同致死机理,是治疗ES的理论依据。
图2 Tazemetostat 在INI1缺失细胞中的体外活性
EZH2抑制剂研发方向和潜在适应症
作为EZH2新靶点的“First in class”药物,Tazemetostat此次批准的适应症仅是发病率极低的上皮样肉瘤(ES), 但可以让“少人关心少人问”的ES患者看到了继续延长生命的希望,让研究EZH2靶点的企业看到了EZH2靶点临床成药性的信心。
除了Tazemetostat在ES上获得了成功,斩获信心的Epizyme公司近日通过加速审批策略已提交了适应症为至少经历两次系统治疗失败的滤泡性淋巴瘤(FL)的NDA申请。 2019年美国血液病年会(2019 ASH)上,Epizyme公司更新了Tazemetostat在复发难治性FL上的抗肿瘤活性结果。
在EZH2突变型(MT)和野生型(WT)患者上Tazemetostat单药治疗ORR分别为69%和35%,分别有13%和4%的患者达到了完全缓解。安全性方面,耐受良好。在所有招募的99例FL患者,3级或以上治疗相关的不良事件(TEAEs)仅有3%出现血小板减少症,2%贫血,1%虚弱,1%疲劳,治疗过程中,仅有8%患者因TEAEs中止治疗,9%患者降低剂量继续治疗。此外,Tazemetostat还在弥散性大B细胞淋巴瘤(DLBCL)和一些实体瘤上证明了活性。
表3 Tazemetostat在r/rFL上的临床试验结果
在EZH2靶点的赛道上,除了走在最前列的Epizyme,国际上大药企均有布局,如Constellation公司CPI-1205/CPI-0209、Novartis MAK683、Daiichi Sankyo DS-3201b(EZH1/2)、Pfizer PF-06821497等处于临床早期,临床试验适应症为有B细胞淋巴瘤、前列腺癌、小细胞肺癌及其他实体瘤等;在国内EZH2抑制剂如恒瑞的SHR2554也正在临床I/II期试验研究中。
表4 EZH2抑制剂国内外临床试验研究进展
数据来源:美国临床试验网
Tazemetostat此次在上皮样肉瘤(ES)上的加速上市,将会大大鼓舞布局EZH2抑制剂的研发企业继续推进与EZH2异常相关临床适应症(包括罕见性疾病)的开发,未来EZH2靶点的适应症将会进一步拓宽,期盼更多EZH2新药尽早造福患者。
EZH2靶点新药市场潜力分析
1
EZH2靶点新药市场空间巨大
EZH2抑制剂目前主要适应症是非霍奇金淋巴瘤(Non-Hodgkinlymphoma,NHL),而NHL根据细胞形态和病理类型分为弥散性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)和慢性淋巴细胞白血病/小淋巴细胞瘤(CLL/SLL)等亚类。据2018年IARC 统计 [9] ,全球NHL新发病例近51万例,占据所有新发癌症病例的2.8%,发病率呈逐渐上升趋势。
全球范围 内 [10] , 2018年 NHL市场创造了64亿美元的收入,较2013年的45亿美元大幅增加。2018年抗CD20单抗,即利妥昔单抗和obinutuzumab, 在NHL市场占主导地位,占销售额的65%;其次是BTK和PI3Kγ/δ抑制剂,即ibrutinib和idelalisib占销售额的19%。按 复合年增长率为7.7% 预计,到2023年NHL市场将达93亿美元。
2
EZH2靶点新药单药活性优势明显
通过分析不同靶点药物在复发难治性滤泡性淋巴瘤(r/r FL)单用的临床数据发现,Tazemetostat单药在r/r FL(MT EZH2)上ORR高达69%,提示近70%的复发难治性FL( MT EZH2)患者对EZH2抑制剂出现积极响应,单药活性远高于BTK抑制剂(包括近日刚刚美国上市的百济神州泽布替尼)、PI3K抑制剂和BCL2抑制剂。
表5 不同靶点药物在复发难治性FL上的单用疗效
数据来源: FDA官网、研发公司官网以及参考文献
根据最新NCCN指南-B细胞瘤临床实践指南(2019.v 6),三款PI3K抑制剂(idelalisib,copanlisib和duvelisib)单药被推荐用于至少经历2次系统治疗的复发难治性FL的治疗,而Tazemetostat凭借在FL上优异的有效性和良好的安全性,被批准似乎只是时间问题,未来上市后势必会挤占PI3K抑制剂在指南上的位置,市场竞争一触即发。
3
EZH2靶点新药联合用药潜力巨大
单个靶点药物在FL上难以满足临床的需求,需要多个靶点药物联用或联合化疗方案才能满足患者所需。
比如,BTK抑制剂尽管在复发难治性FL上的单药活性不是很理想(如泽布替尼单药ORR为41%,CR为18%),在与Obinutuzumab联用后,ORR提高到72%,CR提高到39%;Obinutuzumab作为第三代CD20单抗,在复发难治性FL上的单药活性也差强人意(ORR为55%,CR9%),但与化疗方案CHOP(cyclophosphamide,doxorubicin, vincristine and prednisone)联用之后,ORR提高到96%,CR提高到39%,与FC化疗方案(fludarabineand cyclophosphamide)联用之后,ORR提高到了93%,CR提高到50%。
而Tazemetostat凭借单药活性在FL(MT EZH2)上的“一枝独秀”和良好的耐受性,未来若能联合其他靶点药物或化疗组合方案,很大可能性会超越其他靶点的联用疗效,而这也势必会考验着sponsor的深谋远虑和战略决策。
表6 Tazemetostat在DLBCL上的初期单药活性
数据来源:Epizyme
此外,在复发难治性弥散性大B细胞淋巴瘤(DLBCL),EZH2抑制剂Tazemetostat也表现出了单药治疗的活性(I/II期研究NCT01897571)。基于此,Tazemetostat联合泼尼松龙(Prednisolone)正在开展r/r DLBCL的临床试验,Tazemetostat联合经典的R-CHOP方案进行一线治疗DLBCL的治疗。
表7 EZH2抑制剂联用方案临床研究进展
除了在血液系统肿瘤上证实的活性,EZH2抑制剂与AR受体抑制剂、免疫检查点抑制剂等联用在一些实体瘤上如前列腺癌、小细胞肺癌、尿路癌、膀胱癌等均有潜在的临床活性(数据来源:美国临床试验网和中国临床试验登记平台)。随着EZH2靶点的研究深入,未来或许有更多的适应症等待开发,EZH2抑制剂未来市场可期!
EZH2靶点值得FAST-FOLLOW
EZH2靶点值不值得国内药企开启FAST-FOLLOW模式? 小编认为是非常值得的! 有六大理由:
1
临床成药的确定性
此次Tazemetostat在ES适应症上被FDA批准上市,证实了EZH2抑制剂的临床活性,同时如同INI1缺失的ES,更多的基因异常导致EZH2活性增强的肿瘤,都有可成为EZH2抑制剂的适应症。在血液系统肿瘤如FL和DLBCL上,目前EZH2抑制剂在临床试验中显示出了显著的抗肿瘤活性,Epizyme已进行FL的NDA申请,第二个适应症的上市未来可期。在一些实体瘤上,临床前的模型证实了EZH2抑制剂的活性,多项临床试验也正在开展。
2
良好的开发机遇和时机
目前,EZH2抑制剂大多处于临床开发的前期,很多临床试验在摸索中前进,除了Tazemetostat,多数EZH2抑制剂上市大概至少需要3年的时间,尤其在一些血液系统肿瘤如DLBCL和实体瘤上,可能需要联合用药的临床实验来提高疗效,这就需要更多的时间来探索。国内药物公司可根据前者积累的经验,可缩短临床研发的时间,达到FAST-FOLLOW的目的。
3
联合用药方案处于“同一起跑线”
EZH2抑制剂的联合用药是大势所趋,各大公司均在临床试验尝试不同的方案,比如Epizyme计划使用Tazemetostat联合R2(来那度胺和利妥西单抗,一种无化疗药物的组合方案)进行III期试验,期望进一步提高单药的活性。
能否达到联合用药的临床期望?成功率有多大?能否升级为一线治疗方案?哪种组合方案最有效?一切还是未知,而正是这些不确定性给国内的医药公司提供了“弯道超车”的机会和可能,谁能发现最有效最安全的联合方案,谁便可以像罗氏的R-CHOP(利妥昔单抗联合CHOP)方案治疗NHL一样,问世以来“一直被追赶,从未被超越”。
4
潜在适应症多而广
EZH2抑制剂首先被批准的应该是上皮样肉瘤(ES此次批准)和滤泡性淋巴瘤(已进行NDA),还有更多淋巴瘤的亚类还需要EZH2抑制剂的临床试验验证,比如慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、套细胞淋巴瘤(MCL)、伯特基淋巴瘤(BL)等。
目前,以免疫化学疗法为主的一线治疗手段,对于体质偏弱和老年患者难以耐受,亟需新型的可耐受的有效的靶向药物冲击一线。 此外,多项机制研究证实EZH2在一些实体瘤上均有表达异常。更多更广的潜在适应症和针对性用药患者人群还需要不同企业的EZH2抑制剂去进一步开辟。
5
国内市场尚未形成同质化竞争
现国内只有恒瑞一家的EZH2抑制剂在临 床I/II 期,尚未形成同质化恶性竞争,EZH2靶点药物研发相比于目前“高温90度”的基因突变驱动疾病的抑制剂,初创公司未来更具有“强势逆袭”的可能性和在未来激烈的市场竞争中生存的空间。
6
EZH2抑制剂市场前景广阔
单一从非霍奇金淋巴瘤市场看,到2023年,NHL市场预计将达到将近100亿美元。而小分子靶向药物研发成本相对较低,药物可及性强,一旦EZH2抑制剂在发病率较高的淋巴瘤(比如DLBCL、FL)上取得显著疗效和实体瘤上取得突破进展,将会强势竞争和渗透生物药和其他靶点抑制剂的市场份额。
此外,尽管某一些亚类淋巴瘤发病人群相对较少,比如滤泡性淋巴瘤(FL)、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)等,但这些病理亚类属于惰性淋巴瘤,进展缓慢,患者生存期长,需要长期服用药物,需要提高生存质量。临床需求决定研发方向,EZH2抑制剂前景无限。
展望
EZH2靶点是非常有前景的抗肿瘤药物靶点之一,但由于表观调控机制的复杂性和不确定性,也充满巨大风险和挑战。此次作为首创药(First in class)的Tazemetostat重磅上市,必将激发工业界和学术界对表观遗传靶点的研发热情。未来EZH2抑制剂的适应症有多少?市场份额有多大?哪一款EZH2抑制剂能成为最强(Best in class)?让我们拭目以待!









